Глоссарий терминов по Химии
Глоссарий - это список всех терминов по предмету. В данном случае он позаимствован из Википедии.
абсолютный ноль Теоретическое условие, относящееся к системе на нижнем пределе шкалы термодинамической температуры , или при нуле кельвинов , при котором система не излучает и не поглощает энергию (то есть все атомы находятся в состоянии покоя). Экстраполируя закон идеального газа , международное сообщество определило абсолютный ноль как −273,15 °C (−459,67 °F; 0,00 К). поглощающая способность поглощение 1. Физический или химический процесс, посредством которого вещество в одном состоянии включается в состав другого вещества в другом состоянии и удерживается им. Абсорбция отличается от адсорбции тем, что первое вещество проникает во весь объем второго вещества, а не просто прилипает к поверхности. 2. Процесс , при котором вещество (обычно электроны , связанные в атомах) поглощает энергию электромагнитного излучения и преобразует её в любой из различных видов внутренней энергии, например в тепловую энергию . Этот тип поглощения является принципом, на котором основана спектрофотометрия . изобилие точность Насколько измеренное значение близко к фактическому или истинному значению. Сравните точность . ацетил ахиральный (о молекуле ) Обладающая геометрической симметрией, неотличимая от своего зеркального отражения; не обладающая хиральностью . кислота 1. ( Кислота Бренстеда — Лоури ) Любое химическое вещество или молекулярная структура , которая действует как донор протонов при реакции с другим веществом, поскольку теряет по крайней мере один протон ( H + ), который затем переносится или «дотируется» другому веществу, которое по определению является основанием Бренстеда — Лоури . При растворении в водном растворе донор протонов, который увеличивает концентрацию иона гидроксония ( H 3 O + ) за счёт передачи протонов молекулам воды, также может называться аррениусовской кислотой . Термин «кислота», если не указано иное, часто неявно относится к кислоте Бренстеда — Лоури. [ 1 ] 2. ( Кислота Льюиса ) Любое химическое вещество или молекулярная структура, которая выступает в качестве акцептора электронной пары при взаимодействии с другим веществом, образуя ковалентную связь путём принятия неподелённой пары электронов, предоставленных другим веществом, которое называется основанием Льюиса . Это определение было задумано как обобщение определения Бренстеда — Лоури. Согласно ему, кислотно-щелочные реакции лучше рассматривать как перераспределение электронов, а не протонов. Кислота — это вещество, которое принимает электронные пары от другого вещества либо напрямую, либо путём высвобождения протонов ( H + ) в раствор, которые затем принимают электронные пары от другого вещества. Определение Льюиса включает в себя многие кислоты Бренстеда — Лоури, но не все: большинство кислот Льюиса не являются кислотами Бренстеда — Лоури, а большинство кислот Бренстеда — Лоури не являются кислотами Льюиса. [ 1 ] 3. В разговорной речи так называют любое соединение, которое при растворении в воде даёт pH менее 7,0. Термин «кислота» обычно используется для обозначения всего водного раствора , тогда как более строгие определения относятся только к кислотному растворителю . [ 2 ] кислотный ангидрид Любое химическое соединение , полученное путём удаления молекул воды из кислоты . В отличие от основного ангидрида . константа диссоциации кислоты ( K a ) Количественная мера силы кислоты в растворе , выраженная как константа равновесия химической реакции диссоциации в контексте кислотно-щелочных реакций . Часто выражается в виде логарифма по основанию 10, p K a . кислотно–щелочная экстракция Химическая реакция , в ходе которой химические вещества отделяются от других кислот и оснований . кислотно–щелочная реакция кислотный актиниды Периодическая таблица металлических элементов с атомными номерами от 89 до 103, от актиния до лоуренсия . активированный комплекс Структура, которая образуется в результате столкновения молекул при формировании новых связей. энергия активации Минимальная энергия , которая должна быть доступна химической системе с потенциальными реагентами , чтобы произошла определённая химическая реакция . серия действий Смотрите ряд реактивностей . фактический выход ациклический Содержащий только линейные структуры атомов (особенно в углеводородах ). реакция присоединения В органической химии — тип химической реакции, при которой две или более молекул соединяются в более крупную молекулу. аддукт Отдельный химический вид , который является единственным продуктом реакции присоединения между двумя другими отдельными реагентами , в которой все атомы, входящие в состав реагентов, сохраняются в составе одного продукта. Могут происходить изменения в связях, но не происходит потери ни одного из исходных атомов и не происходит присоединения атомов, которых нет в молекулах реагентов. Стехиометрия , отличная от 1:1, также возможна, например, бис-аддукт (2:1). [ 2 ] адгезия Склонность разнородных частиц или поверхностей притягиваться друг к другу в результате действия межмолекулярных сил . Противоположность когезии . адсорбция Химическая адгезия атомов, ионов или молекул одного вещества (будь то газ , жидкость или растворённое твёрдое вещество ) к поверхности другого вещества, в результате чего на границе раздела двух веществ образуется слабо связанная с ними плёнка первого вещества. Адсорбция отличается от абсорбции тем, что является исключительно поверхностным явлением, в то время как абсорбция затрагивает весь объём материала. аэрация Смешивание воздуха с жидкостью или твердым веществом. алкоголь Любое органическое соединение , состоящее как минимум из одной гидроксильной группы , присоединённой к насыщенному атому углерода. Общая формула спиртов — R–OH. альдегид Функциональная группа и класс органических соединений, состоящих из карбонильной группы, присоединённой к атому водорода и любой другой R-группе . Альдегиды имеют общую формулу R–C(H)=O. алифатический щелочной металл Любой из металлических элементов , относящихся к 1-й группе периодической таблицы : литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). щелочной щелочноземельный металл Любой из металлических элементов , относящихся ко второй группе периодической таблицы : бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). алкан Любой полностью насыщенный ациклический углеводород , то есть такой, в котором все связи между атомами углерода являются одинарными . алкен Любой ненасыщенный углеводород , содержащий хотя бы одну двойную связь между атомами углерода. алкокси алкил Заместительная форма алкана , то есть любого алкана, в котором отсутствует атом водорода. Этот термин может использоваться для широкого описания множества различных функциональных групп , например, метильной , этильной или пропильной группы. алкин Любой ненасыщенный углеводород , содержащий хотя бы одну тройную связь углерод-углерод . алломер Вещество, которое отличается по химическому составу, но имеет ту же кристаллическую структуру, что и другое вещество. аллотроп Любая из множества различных структурных форм одного и того же элемента, например, углерода , аллотропы которого включают алмазы , графит и фуллерен . сплав Смесь металлов или металла с другим элементом , которые в сочетании проявляют металлическую связь . К распространённым примерам относятся бронза , латунь и олово . амальгама Любой сплав ртути с другим металлом . окружающий Молекула или функциональная группа , имеющая два альтернативных и взаимодействующих реакционных центра, с любым из которых может образоваться связь в ходе реакции . амид аммиачный Описывает раствор , в котором растворителем является водный раствор аммиака . [ 3 ] аморфное твердое вещество количество вещества Количество дискретных частиц (таких как молекулы , атомы , ионы , электроны или любые другие объекты атомного масштаба) в заданном образце вещества , делённое на постоянную Авогадро . Единицей измерения количества вещества в СИ является моль (моль). амфипатический (о молекуле ) Состоит как из гидрофильных , так и из гидрофобных групп; например, смачивающие вещества и мембранные липиды. [ 4 ] амфотерный (о химическом веществе ) способное вести себя как кислота или как основание в зависимости от среды, в которой находится вещество; например, серная кислота (H 2 SO 4 ) является сильной кислотой в воде, но ведёт себя скорее как основание в сверхкислотах . амил Распространенное несистематическое название пентильной группы. анализируемый материал Конкретное вещество или химический компонент, представляющий интерес для химического анализа . аналитическая химия Раздел химии, изучающий и использующий инструменты и методы для разделения, количественного определения и идентификации химических веществ как с помощью классических методов мокрой химии , таких как осаждение , экстракция , дистилляция и наблюдение, так и с помощью современных инструментальных методов, таких как хроматография , спектроскопия и электрохимия . ångström (Å) Не относящаяся к СИ метрическая единица измерения длины, равная 10 −10 метра , то есть 1 ⁄ 10000000000 метра или 0,1 нанометра . Ангстрем обычно используется в естественных науках для измерения расстояний в микроскопическом или атомном масштабе, включая размеры атомных ядер, длины волн электромагнитного излучения и длины химических связей (например, ковалентный радиус атома хлора в среднем составляет около 1 ангстрема). безводный Не содержащий или не имеющий молекул воды , особенно воды гидратации . [ 4 ] Поскольку многие химические процессы затруднены в присутствии воды, часто критически важно использовать реагенты и методы, не содержащие воду. Безводные соединения имеют тенденцию постепенно поглощать воду из атмосферы. Противоположность водному . анион Отрицательно заряженный ион , то есть атом или молекула с суммарным отрицательным электрическим зарядом, вызванным избытком электронов по сравнению с протонами . аннулирование Образование циклического соединения или кольцевой структуры из одного или нескольких ациклических предшественников; или реакция, при которой кольцевая структура присоединяется к другой молекуле посредством двух новых связей. [ 2 ] анод 1. Электрод , через который обычный электрический ток (поток положительных зарядов) поступает в поляризованную электрическую цепь. 2. Проводник или пластина электрохимической ячейки , имеющие избыточный положительный заряд. Отрицательно заряженные анионы всегда движутся к аноду. В противоположность катоду . аномер Любой из пары циклических полуацеталей или полукетальных сахаров , которые являются эпимерами друг друга и отличаются только одним стереоцентром углерода, а именно углеродом, несущим альдегидную или кетоновую функциональную группу в ациклической, открытой конфигурации соединения, известной как аномерный углерод . апротичный (о химическом веществе) Не протонированное , то есть не способное выступать в качестве протонного донора или легко отдавать протоны ( H + ) в растворе. aqua regia Жидкая смесь азотной кислоты (HNO 3 ) и соляной кислоты (HCl), оптимально в молярном соотношении 1:3, названная так историческими алхимиками, потому что она способна растворять благородные металлы золото и платину . аквация Процесс, при котором молекулы воды сольватируют или образуют координационные комплексы с ионами . [ 3 ] водный раствор Раствор , в котором растворителем является вода . В химических уравнениях он обозначается (aq) после химической формулы . ароматный ароматичность Химическое свойство сопряжённых колец атомов, таких как бензол , которое обеспечивает необычайно высокую стабильность. Такие кольца называются ароматическими . Кислота Аррениуса Любое вещество, которое при растворении в воде увеличивает концентрацию H +
ионов или, точнее, ионов гидроксония ( H 3 O + ) в полученном водном растворе . [ 1 ] Определение аналогично определению кислоты Бренстеда — Лоури . Противоположность основанию Аррениуса . База Аррениуса Любое вещество, которое при растворении в воде увеличивает концентрацию OH −
ионов или, наоборот, уменьшает концентрацию ионов гидроксония ( H 3 O + ) в полученном водном растворе . [ 1 ] Определение аналогично определению основания Бренстеда — Лоури . В отличие от аррениусовской кислоты . нажатие стрелки арил Любая функциональная группа или заместитель , образованные из ароматического кольца , например фенил или нафтил . Символ Ar часто используется в качестве обозначения общей арильной группы на структурных схемах. атмосферолиз Разделение смеси газов путём использования различий в скорости их диффузии , обычно путём пропускания газов через стенки пористой перегородки или мембраны. [ 3 ] атом Химический элемент в своей наименьшей форме, состоящий из протонов и нейтронов в ядре и электронов , вращающихся вокруг ядра. атомная масса Масса атома , обычно выражаемая в дальтонах и почти равная атомному номеру , умноженному на один дальтон. единица измерения атомной массы Увидимся с Далтоном . атомный номер ( Z ) Количество протонов , содержащихся в ядре атома данного химического элемента . Оно совпадает с зарядным числом ядра и используется в периодической таблице для уникальной идентификации каждого химического элемента. атомная орбиталь Любая область, в которой один или несколько электронов могут находиться в отдельном атоме (в отличие от молекулы ). атомный радиус атомный вес Смотрите относительную атомную массу . атомарность Общее количество атомов , присутствующих в одной молекуле данного вещества; например, озон (O 3 ) имеет атомность 3, а бензол (C 6 H 6 ) — 12. [ 3 ] температура самовоспламенения Самая низкая температура, при которой данное вещество самовоспламеняется в обычной атмосфере без внешнего источника воспламенения, такого как пламя или искра, то есть когда температура окружающей среды достаточно высока, чтобы обеспечить энергию активации , необходимую для горения . Вещества, которые самовоспламеняются при естественных температурах, называются пирофорными . Сравните с температурой воспламенения . Постоянная Авогадро ( N A ) Отношение количества дискретных составляющих частиц (таких как молекулы , атомы или ионы ) к количеству вещества , равное точно 6,022 140 76 × 10 23 моль −1 . Число Авогадро Число дискретных составляющих частиц в одном моле вещества, равное точно 6,02214076 × 10 23 . Это безразмерное число отличается от постоянной Авогадро тем, что не имеет единицы измерения. Закон Авогадро азеотроп Смесь жидкостей , химический состав которой не меняется при дистилляции .

баланс позвоночник Основная или наиболее структурно значимая часть молекулы по отношению к другим её частям, функциональным группам , молекулярным фрагментам или заместителям ; или, в случае полимера , линейная цепочка атомов, к которой все остальные цепочки, длинные или короткие, могут рассматриваться как примыкающие или боковые цепи . Если две или более цепочек могут считаться основной, то основной считается та, которая позволяет наиболее просто представить молекулу в химических формулах и номенклатуре. [ 2 ] барометр Прибор, используемый для измерения атмосферного давления. База Вещество, которое принимает протон и имеет pH выше 7,0. Типичным примером является гидроксид натрия (NaOH). базовый ангидрид Оксид металлического элемента I или II группы. Базовые модели основность батарея мензурка Цилиндрический сосуд или ёмкость с плоским дном, чаще всего представляющая собой разновидность стеклянной посуды , широко используемой в лабораториях для различных целей, таких как приготовление, хранение, содержание, сбор или измерение объёма химических веществ, образцов или растворов, а также в качестве камеры, в которой происходит химическая реакция . Мензурки отличаются от колб прямыми, а не скошенными стенками; у большинства мензурок также есть небольшой носик на краю для удобства переливания. Пиво–закон Ламберта биохимия Изучение химии биологических систем и организмов. Модель Бора Модель общей структуры атома , предложенная Нильсом Бором и Эрнестом Резерфордом в 1913 году, представляет собой небольшое плотное ядро из положительно заряженных частиц , окружённое вращающимися электронами , которые притягиваются к ядру электростатическими силами. Эта интерпретация заменила несколько более ранних гипотез и быстро стала общепринятой стандартной моделью для описания атомной структуры. кипящий Более быстрая и энергичная форма испарения , при которой вещество претерпевает фазовый переход из жидкого состояния в газообразное , в отличие от гораздо более медленного процесса испарения. Кипение происходит, когда жидкость нагревают до точки кипения , при которой внутреннее давление пара жидкости превышает давление окружающей атмосферы, в результате чего газообразная фаза быстро и часто резко отделяется от жидкой фазы. колба для кипячения Тип колбы , обычно изготовленной из стекла, с большим круглым корпусом, длинным горлышком и плоским дном, предназначенный специально для нагревания, кипячения и дистилляции жидкостей, а также для облегчения перемешивания. См. также колбу с круглым дном . температура кипения Температура , при которой вещество меняет состояние с жидкого на газ (или пар ). Это зависит от давления и обычно указывается для данного вещества в стандартных условиях . повышение температуры кипения Процесс, при котором температура кипения вещества повышается за счёт добавления другого вещества. связь Любое устойчивое притяжение между атомами , ионами или молекулами , которое позволяет образовывать химические соединения . Связи возникают в результате действия множества электрохимических сил, сила которых может значительно варьироваться; они разрываются, когда эти силы преодолеваются другими силами. Типы, сила и количество связей, удерживающих химические вещества вместе, определяют структуру и объёмные свойства вещества . угол склеивания Закон Бойля Для заданной массы газа при постоянной температуре объём обратно пропорционален давлению. Закон Брэгга мост Химическая связь между валентными электронами или атомом или неразветвлённой цепью атомов, соединяющих две разные части одной молекулы; то есть внутримолекулярная связь, соединяющая разные части или функциональные группы . [ 2 ] плацдарм Любой из двух третичных атомов, которые, соединяясь друг с другом, образуют внутримолекулярный мостик . [ 2 ] Кислота Бренстеда–Лоури Любое химическое вещество, которое легко отдает протон . Кислотно–щелочная реакция Бренстеда–Лоури База Бренстед–Лоури Любое химическое вещество, которое легко принимает протон . Броуновское движение Büchner flask буферизованное решение Водный раствор , состоящий из слабой кислоты и её сопряжённого основания или слабого основания и его сопряжённой кислоты , который не меняет pH при добавлении сильных кислот или оснований. натыкаясь Явление, при котором однородная жидкость, нагретая до точки кипения , становится перегретой и при образовании зародышей быстро переходит в газообразное состояние, что приводит к резкому выбросу жидкости из сосуда; в крайних случаях сам сосуд может разбиться. Частое перемешивание, использование подходящего сосуда и кипящей стружки могут помочь предотвратить выплескивание. пробка Цилиндрическая или коническая пробка или крышка, используемая для герметизации ёмкости, например бутылки, трубки, фляги или бочки. бюретка Стеклянная посуда, используемая для дозирования определённого количества жидкости , когда необходима точность (например, при титровании и ресурсозависимых реакциях ). бутиловый Алкильная функциональная группа , образованная одним из двух изомеров бутана , с общей химической формулой – C 4 H 9 . Она может выступать в качестве заместителя в органических соединениях или существовать независимо в виде иона или радикала. В номенклатуре ИЮПАК наличие бутильного заместителя обозначается префиксом бутил в названии соединения или аббревиатурой Bu в химических формулах; например, бутиловый спирт (бутанол), который может существовать в любой из пяти различных изомерных форм в зависимости от расположения четырёх атомов углерода, часто обозначается общей формулой CH 4 CH 9 OH или BuOH .
теплотворная способность Показатель теплоты на единицу массы , выделяемой при полном сгорании данного вещества, обычно выражается в мегаджоулях на килограмм (МДж/кг) или в килоджоулях на грамм (кДж/г). [ 3 ] калориметр Любое из различных устройств, используемых для измерения тепловых свойств (т. е. тепла ), таких как теплотворная способность или теплота химических реакций. [ 3 ] калькс Оксид металла, образующийся при нагревании руды на воздухе. [ 3 ] карбанион Любой органический ион с отрицательным зарядом на атоме углерода , то есть ион общей формулы R 3 C − . Карбанионы часто являются промежуточными продуктами в некоторых органических реакциях. [ 3 ] В отличие от карбокатионов . карбид Класс интеркалированных соединений , состоящих из углерода , связанного с определённым металлом (обычно с переходным металлом большого радиуса) в плотноупакованной кристаллической решётке, где атомы углерода занимают промежутки между атомами металла; например, карбид вольфрама (WC). карбокатион углерод углекислота карбонизация 1. Преобразование органических соединений , например, содержащихся в биологических организмах, в другие формы углерода или углеродные остатки путём нагревания или сжигания, а также в процессе окаменения. 2. Процесс покрытия вещества остатками углерода, такими как древесный уголь, или придание веществу обугленного, почерневшего или обугленного вида. карбонил 1. Функциональная группа , состоящая из атома углерода, двойно связанного с атомом кислорода , с формулой . Карбонильные группы характерны для многих классов органических соединений, а также являются частью многих более крупных функциональных групп. 2. Неорганический или металлоорганический координационный комплекс с монооксидом углерода в качестве лиганда (например, карбонил металла ). карбоксильный карбоновая кислота Класс органических кислот и функциональная группа , состоящая из карбоксильной группы, присоединённой к заместительной группе. Карбоновые кислоты имеют общую формулу (также записывается как ), где может быть алкильным , алкенильным , арильным или любым другим углеродсодержащим заместителем. Регистрационный номер CAS (CAS RN) Уникальный числовой идентификатор, присваиваемый Службой химических рефератов (CAS) каждому химическому веществу , описанному в открытой научной литературе, включая более 182 миллионов органических и неорганических соединений, минералов , изотопов , сплавов , полимеров и смесей , а также так называемых «UVCB» (веществ неизвестного или переменного состава, сложных продуктов реакций или биологического происхождения). Номера CAS являются международно признанным стандартом, используемым учёными, промышленными предприятиями и регулирующими органами. [ 5 ] катализатор Любой элемент или соединение, которое способствует увеличению скорости химической реакции , но не расходуется и не разрушается в ходе реакции. Оно считается как реагентом , так и продуктом реакции. катод Электрод , с которого обычный электрический ток (поток положительных зарядов) выходит из поляризованной электрической цепи. Положительно заряженные катионы всегда движутся к катоду, хотя полярность катода может быть положительной или отрицательной в зависимости от типа электрического устройства и способа его работы. Противоположность аноду . катион Положительно заряженный ион . потенциал клетки Сила в гальванической ячейке , которая притягивает электроны от восстановителя к окислителю. центрифугирование Лабораторный метод, который предполагает применение центробежной силы для разделения частиц в растворе в зависимости от их размера, формы и плотности. Более крупные и/или плотные вещества перемещаются от оси центрифуги , а более мелкие и/или менее плотные вещества перемещаются к оси. центрифуга Устройство, используемое для разделения веществ по размеру, форме и плотности с помощью центрифугирования , то есть вращения сосудов, содержащих вещества, вокруг центральной оси с очень высокой скоростью. цепная реакция номер заряда Квантованное значение электрического заряда , рассчитанное как электрический заряд в кулонах , делённый на постоянную элементарного заряда , или z = q / e . Заряды ионов обозначаются верхним индексом (например, Na + обозначает ион натрия с положительным зарядом). Атомные номера — это заряды атомных ядер . Закон Чарльза Классический закон идеального газа гласит, что при постоянном давлении на образец сухого газа температура по шкале Кельвина прямо пропорциональна его объёму . хелатирующий агент хелатирование Тип связывания , включающий образование двух отдельных координатных ковалентных связей между полидентатным лигандом и единственным центральным ионом металла . Л иганд обычно представляет собой органическое соединение , называемое хелантом или хелатирующим агентом . химический Видеть химические соединения и химическое соединение .химическая связь Увидеть связь . химический состав Идентификация и относительное количество элементов , из которых состоит химическое соединение , часто могут быть выражены с помощью химической формулы . химическое соединение См. состав . химическое разложение Распад одной частицы или объекта (например, молекулы или реакционноспособного промежуточного соединения ) на два или более фрагмента или химическая реакция , в результате которой из одного реагента образуются два или более продукта . В отличие от химического синтеза . химический элемент Увидеть элемент . химическая формула Любое из различных средств краткого отображения информации о химическом составе соединения или молекулы с помощью букв, цифр и/или типографских символов. Химические формулы, такие как эмпирические и молекулярные формулы , могут указывать только на идентичность и количественное соотношение атомов в соединении и поэтому менее информативны, чем химические названия и структурные формулы . химический закон Закон природы , относящийся к химии , например, закон сохранения массы . химическая номенклатура химическая физика химический процесс 1. Любой метод или способ изменения одного или нескольких химических веществ или химических соединений каким-либо образом, естественным или искусственным, спонтанно или под воздействием внешних сил. 2. В химической инженерии — любой метод, используемый в промышленных масштабах (особенно в производстве ) для изменения состава одного или нескольких химических веществ или материалов. химическая реакция Превращение одного или нескольких веществ в одно или несколько других веществ. химические соединения Химическое вещество или совокупность веществ, состоящих из химически идентичных молекулярных структур , которые могут исследовать один и тот же набор молекулярных энергетических уровней в характерной или определённой временной шкале. химическое вещество Форма вещества , которая имеет постоянный химический состав и характерные свойства и не может быть разделена на более простые компоненты чисто физическими методами (то есть без разрыва химических связей ). Её часто называют чистым веществом , чтобы отличать от смеси . химический синтез Искусственное проведение одной или нескольких химических реакций для получения одного или нескольких продуктов . В современных лабораториях конкретные химические синтезы являются надёжными и воспроизводимыми. химия Научная дисциплина, изучающая химические вещества , соединения и молекулы , состоящие из атомов различных химических элементов , а также их состав , структуру, свойства, поведение и изменения, которым они подвергаются в ходе реакций с другими веществами. хиральность Свойство асимметрии , при котором молекула или ион отличаются от своего зеркального отражения таким образом, что их нельзя наложить друг на друга с помощью любой комбинации геометрических поворотов, перемещений или некоторых конформационных изменений. [ 6 ] [ 7 ] Такая молекула или ион называются хиральными и существуют в двух формах, известных как энантиомеры , которые являются стереоизомерами друг друга; эти формы различаются как «правые» и «левые» по абсолютной конфигурации или по какому-либо другому критерию. Несколько различных типов асимметрии могут приводить к хиральности, чаще всего когда молекулы обладают стереогенными элементами, такими как один или несколько стереоцентров ( центральная хиральность ), стереогенная ось ( осевая хиральность ) или стереогенная плоскость ( плоская хиральность ); кроме того, присущая молекуле кривизна может приводить к присущей ей хиральности . хроматография хромометр Смотрите колориметр . цис-транс- изомерия закрытая система кластер сплоченность Склонность одинаковых частиц или поверхностей притягиваться друг к другу в результате действия межмолекулярных сил . Противоположность адгезии . совокупительное свойство Любое свойство раствора , зависящее от соотношения количества частиц растворённого вещества к количеству частиц растворителя в растворе, а не от природы присутствующих химических веществ . Примеры включают осмотическое давление , понижение температуры замерзания и повышение температуры кипения . коллоидный Смесь , в которой микроскопические нерастворимые частицы находятся во взвешенном состоянии и равномерно распределены в другом веществе, обычно жидком, но иногда включающем аэрозоли и гели. Таким образом, коллоид состоит из дисперсной фазы и сплошной фазы. Многие молочные продукты являются коллоидами. стандартный цвет Жидкий раствор известного химического состава и концентрации, а следовательно, известного и стандартизированного цвета, используемый в качестве эталона при оптическом анализе образцов неизвестной концентрации. [ 4 ] цветовой тест Количественный анализ вещества путём сравнения интенсивности окраски, возникающей при воздействии на вещество реагентом , со стандартной окраской , возникающей аналогичным образом в растворе известной концентрации. [ 4 ] колориметр Любой прибор, используемый для измерения цвета на основе оптического сравнения со стандартными цветами , [ 2 ] в частности, устройство, используемое в колориметрии для измерения поглощения определённых длин волн света данным раствором с целью определения концентрации известного растворённого вещества в растворе с помощью принципа, согласно которому концентрация растворённого вещества прямо пропорциональна поглощению . горение Экзотермическая реакция между окислителем и топливом, при которой выделяется большое количество тепла и часто света. Комиссия по изотопному составу и атомным массам (CIAAW) сложный Молекулярное образование, образованное в результате слабой связи между двумя или более молекулярными образованиями ( ионными или незаряженными) или соответствующими химическими видами . Связь между компонентами обычно слабее, чем ковалентная связь . [ 2 ] См. также координационный комплекс . соединение Вещество , состоящее из двух или более химически связанных элементов . Правило Комптона Эмпирический закон физической химии , согласно которому теплота плавления данного элемента , умноженная на его атомную массу и затем делённая на температуру плавления в кельвинах , всегда равна примерно 2. [ 4 ] объединитель концентрация Количество или содержание компонента смеси в единице объёма этой смеси; например, количество в молях растворённого вещества в единице объёма раствора , мера, известная как молярная концентрация или молярность. В химии широко используются несколько различных определений концентрации, в том числе молярная концентрация, массовая концентрация и объёмная концентрация . конденсация Фазовый переход вещества из газа в жидкость . надежность Сравнительное измерение электропроводности раствора , определяемое как молярная концентрация раствора хлорида натрия (NaCl), имеющего такую же удельную электропроводность, как и исследуемый раствор. Обычно выражается в молях на литр (или на какую-либо другую единицу объёма). проводимость проводимость Видеть электрическая проводимость и теплопроводность .проводник Любой объект или материал, который пропускает электрический ток в одном или нескольких направлениях. В отличие от изолятора . конформация Пространственное расположение атомов, позволяющее различать стереоизомеры , которые могут превращаться друг в друга путём вращения вокруг формально одинарных связей . конъюгатная кислота сопряженное основание сопряженная система Молекула , содержащая двойные или тройные связи, разделённые одной одинарной связью ; например, соединение бута-1,3-диен с химической структурой H 2 C=CH−CH=CH 2 имеет сопряжённые двойные связи. В таких молекулах наблюдается некоторая делокализация электронов на пи-орбиталях между атомами углерода, соединёнными одинарной связью. [ 3 ] конституциональный изомер См. структурный изомер . конституционная единица Атом или группа атомов (включая примыкающие атомы или группы, если таковые имеются), составляющие часть структуры макромолекулы , олигомера , полимера , блока или цепи . [ 2 ] конвекция кривая охлаждения Линейный график, представляющий изменение между различными фазами вещества , обычно от газа к твёрдому веществу или от жидкости к твёрдому веществу, в зависимости от времени и температуры; например, показывающий, как температура жидкого вещества изменяется со временем по мере его конденсации ниже точки замерзания . координатная химия координатная ковалентная связь См. дипольную связь . координационный комплекс Химическое соединение , состоящее из центрального атома или иона , обычно металлического и известного как координационный центр , связанного с окружающими его группами атомов, например молекулами или ионами, которые известны как лиганды или комплексообразующие агенты . Многие металлосодержащие соединения, особенно соединения переходных металлов , являются координационными комплексами. См. также комплекс . коррозия Необратимая межфазная химическая реакция материала, особенно металла , с окружающей средой, которая приводит к разрушению материала или растворению в материале внешнего компонента окружающей среды. кулон (C) Единица СИ измерения электрического заряда , определяемая как заряд, переносимый постоянным током в один ампер за одну секунду . противодействие Ион , который является противоположно заряженным ионом в диссоциированной ионной паре ; катион , который образует пару с данным анионом , или наоборот. Например, Na + является противоионом Cl − , и наоборот, в растворах хлорида натрия (NaCl). ковалентная связь Связь , которая включает совместное использование электронных пар между атомами . Стабильный баланс сил притяжения и отталкивания, возникающий между атомами, когда они совместно используют электроны, известен как ковалентная связь . критическая точка Конечная точка кривой фазового равновесия или кривой давления - температуры , при которой условия таковы, что фазовые границы исчезают и различные фазы вещества, такие как жидкость и пар , могут сосуществовать. Критическая точка определяется пересечением критической температуры T c и критического давления p c ; при температуре и давлении выше этой точки все различия между фазами исчезают, и вещество становится сверхкритической жидкостью . тигель Керамическая или металлическая посуда или другой сосуд, в котором вещества могут плавиться или иным образом подвергаться воздействию очень высоких температур. [ 3 ] кристалл Твёрдое вещество , частицы которого (например, атомы, ионы или молекулы) расположены в упорядоченной периодической микроскопической структуре, образуя решётку с определённой геометрией, которая простирается во всех направлениях. Такие материалы часто называют кристаллическими . кристаллизация точка кристаллизации Смотрите точку замерзания . кристаллография Раздел химии, изучающий кристаллические твёрдые тела, в том числе их структуру и свойства. кювета Тип небольшого контейнера, используемого в экспериментах по спектроскопии . Обычно изготавливается из пластика, стекла или кварца и предназначен для хранения образца (как правило, жидкости) для измерения внутри спектрометра . Кюветки должны быть максимально чистыми и прозрачными, чтобы свести к минимуму помехи для световых лучей, на которых основаны спектроскопические методы. циклический




далтон (Da) Единица массы , определяемая как 1 ⁄ 12 массы свободного невозбуждённого атома углерода-12 в состоянии покоя. Она приблизительно равна массе одного нуклона . Закон парциальных давлений Дальтона Эмпирический закон, согласно которому в смеси не вступающих в реакцию газов общее давление , оказываемое всеми газами вместе, равно сумме парциальных давлений, оказываемых каждым газом по отдельности. d-блок дательная связь См. дипольную связь . дебай (D) Единица измерения электрического дипольного момента , не входящая в СИ, определяется как 10 −18 стат-кулон-сантиметров. См. также электрический дипольный момент . деионизация Удаление ионов из раствора любым способом. В случае с водой обычно речь идёт о минеральных ионах, таких как натрий, железо и кальций. размягчение Склонность вещества к поглощению воды часто характеризуется его способностью поглощать влагу из атмосферы, образуя водные растворы . Наиболее сильно гигроскопичными веществами являются соли , такие как хлорид кальция и карбонат калия . делокализованный электрон Любой электрон в молекуле, ионе или твёрдом металле , который не связан с отдельным атомом или ковалентной связью . Этот термин может относиться к электронам, участвующим в резонансе в сопряжённых системах или ароматических соединениях; к свободным электронам , которые обеспечивают электрическую проводимость ; или к электронам в делокализованных молекулярных орбиталях , охватывающих несколько соседних атомов. плотность Интенсивная характеристика вещества, определяемая как масса на единицу объёма и выражаемая уравнением d = m / V . плотность Количество донорных групп в одном лиганде , которые связываются с центральным атомом в координационном комплексе . отложение Осаждение частиц в растворе или смеси. снижение температуры замерзания См. Пониженную температуру замерзания . осушитель Гигроскопичное вещество, используемое для создания или поддержания состояния сухости или высушивания (т. е. отсутствия влаги) в окружающей среде путём поглощения молекул воды из других веществ. Осушители бывают разных видов и работают по разным принципам: от простого поглощения до химической связи молекул воды. высыхание дейтерий Один из двух стабильных изотопов атома водорода , ядро которого содержит один протон и один нейтрон . Дейтерий тяжелее и встречается в природе гораздо реже, чем другой стабильный изотоп, известный как протий ( 1 H ). дейтрон Ядро атома дейтерия (изотопа водорода ), содержащее один протон и один нейтрон . Колба Дьюара Смотрите вакуумную колбу . дианион Соединение или молекулярная структура, несущая ровно два отрицательных заряда, которые могут быть локализованы на одном атоме или на разных атомах, а также могут быть делокализованы. [ 2 ] диастереомер двухатомный Состоит из двух атомов одного или разных элементов. Сравните одноатомный и многоатомный . двухатомная молекула Любая молекула , состоящая только из двух атомов одного или разных элементов . диффузия Общее перемещение атомов или молекул из области с более высокой концентрацией в область с более низкой концентрацией. Диффузия обусловлена градиентом химического потенциала диффундирующих частиц и зависит от случайного блуждания частиц; следовательно, она приводит к перемешиванию или массопереносу без необходимости направленного объёмного движения. расширяющий Вещество, способное увеличиваться в объёме при изменении своей формы. [ 4 ] разбавление димер Олигомер , состоящий из двух мономеров , соединённых химическими связями, которые могут быть как прочными, так и слабыми, ковалентными или межмолекулярными . Гомодимер состоит из двух одинаковых молекул; гетеродимер состоит из двух разных молекул. дипольная связь Тип ковалентной связи , образованной путём координации двух или более электрически нейтральных фрагментов , сочетание которых приводит к молекуле с разделёнными зарядами или координационному комплексу , в котором два электрона , принадлежащие одному атому, распределяются между донором и акцептором, создавая внутренний двухцентровый молекулярный дипольный момент . [ 2 ] дипольный Электрическое или магнитное разделение электрического заряда на пару зарядов равной величины, но противоположных знаков, один из которых положительно заряжен, а другой отрицательно заряжен, разделённых обычно небольшим расстоянием. дипольный момент Видеть электрический дипольный момент ,магнитный дипольный момент ,молекулярный дипольный момент ,дипольный момент связи ,электрический дипольный момент электрона ,магнитный дипольный момент электрона , и ядерный магнитный момент .дисперсия Система, в которой частицы одного материала распределены в непрерывной фазе другого материала; две фазы могут находиться в одном или разных состояниях . Дисперсии частиц, достаточно крупных для осаждения , называются суспензиями , а дисперсии более мелких частиц называются коллоидами или растворами . диссоциация Любой процесс, при котором многоатомная молекула или молекулярное образование (например, ионное соединение или координационный комплекс ) или совокупность молекулярных образований разделяется или распадается на две или более молекул, атомов, ионов, радикалов или других составляющих, обычно обратимым образом. Примерами являются мономолекулярный гетеролиз и гомолиз , растворение солей и кислотная диссоциация . Противоположность ассоциации . растворение Взаимодействие растворителя с молекулами или ионами растворённого вещества , включающее образование связей, водородные связи и ван-дер-ваальсовы силы . дистилляция Процесс разделения компонентов жидкой смеси путём использования различий в относительной летучести компонентов смеси посредством избирательного кипения и последующей конденсации . Устройство, используемое для дистилляции вещества, называется перегонным кубом , а повторно конденсированное вещество, полученное в результате этого процесса, называется дистиллятом . двойная связь Связь , включающая ковалентное взаимодействие двух пар электронов . двойное разложение двойное смещение двойная соль 1. Соль , состоящая из более чем одного катиона или аниона или образующая при гидролизе два разных катиона и аниона. 2. Соль, представляющая собой молекулярную комбинацию двух других солей. [ 4 ] реакция двойной замены точка падения Температура , при которой смазка переходит из полу- твёрдого состояния в жидкое при стандартных условиях, [ 4 ] , то есть верхний предел, при котором смазка сохраняет свою структуру, хотя это не обязательно максимальная температура, при которой её можно использовать. сухая коробка Камера или контейнер, в которых поддерживается очень низкая влажность, часто путём заполнения их аргоном или воздухом без углекислого газа, чтобы создать инертную атмосферу, в которой в лаборатории можно проводить манипуляции с очень реактивными химическими веществами или процедуры, чувствительные к влаге. [ 4 ] осушающий агент См. Осушитель . пластичность Показатель способности материала подвергаться значительной пластической деформации перед разрушением, обычно выражаемый в процентах удлинения или уменьшения площади поперечного сечения при испытании на растяжение и характеризующий способность материала растягиваться в проволоку. дистектированная смесь Смесь двух или более веществ, которая имеет самую высокую температуру плавления из всех возможных смесей этих веществ. [ 4 ] В отличие от эвтектической смеси .

земной металл См. щелочноземельный металл . кипение Видишь, как кипит . эффективный молекулярный диаметр Физическая протяжённость электронного облака , окружающего молекулу конкретного газа, рассчитывается одним из нескольких способов и обычно выражается в нанометрах или ангстремах . [ 4 ] шипучий Выделение газа из водного раствора без нагревания и сопровождающее его бурление, пенообразование или шипение; например, выделение углекислого газа из газированной воды. электрический заряд Измеряемое свойство ( кулон ) определяет электромагнитное взаимодействие . электрический дипольный момент Мера разделения положительных и отрицательных электрических зарядов внутри электрической системы, т.е. мера общей электрической полярности системы. Единицей измерения электрического дипольного момента в системе СИ является кулоновский метр (C⋅ m), но дебай (D), единица измерения, отличная от системы СИ, также широко используется в химии и атомной физике. электрическая проводимость электрическое сопротивление электричество электризуй Ионное соединение , в котором анионом является электрон . электрохимический элемент Устройство, способное либо вырабатывать электрическую энергию в результате химических реакций, в этом случае оно называется гальваническим или вольтайческим элементом, либо использовать электрическую энергию для запуска химических реакций, в этом случае оно называется электролитическим элементом. Например, аккумулятор содержит один или несколько гальванических элементов, каждый из которых состоит из двух электродов , расположенных таким образом, что реакция окисления-восстановления создаёт электродвижущую силу . электрохимия Раздел физической химии , изучающий взаимосвязь между разностью электрических потенциалов и определяемыми химическими изменениями, которые сопровождаются либо химическими реакциями , возникающими при прохождении электрического тока, либо разностью потенциалов, возникающей в результате конкретной химической реакции. электролит Раствор , проводящий определённое количество электрического тока и условно разделяемый на слабые и сильные электролиты. электромагнитное излучение Тип волны, которая может распространяться как в вакууме, так и в веществе, и классифицируется как самораспространяющаяся волна. электромагнитный спектр электромагнетизм Поля с электрическим зарядом и электрическими свойствами, которые изменяют способ движения и взаимодействия частиц. электродвижущая сила (ЭДС) электрон Тип субатомной частицы с суммарным отрицательным зарядом. Противоположность позитрону . акцептор электронов захват электронов Тип ядерной трансформации, при которой богатое протонами ядро электрически нейтрального атома поглощает или «захватывает» электрон из одной из своих внутренних оболочек, часто ближайших к ядру, что вызывает реакцию, в результате которой ядерный протон превращается в нейтрон с одновременным испусканием электронного нейтрино . [ 2 ] электронная конфигурация Распределение электронов в атоме или молекуле по атомным или молекулярным орбиталям . Для краткого и однозначного отображения информации об электронной конфигурации каждого вида атомов используется обширная система обозначений. Знание конкретного расположения электронов в разных атомах полезно для понимания химических связей и организации периодической таблицы элементов . дефицит электронов донор электронов электрический дипольный момент электрона ( d e ) Внутреннее свойство электрона , при котором его потенциальная энергия линейно связана с напряжённостью его электрического поля; мера распределения отрицательного заряда электрона в электрическом поле, которое он создаёт. См. также электрический дипольный момент . магнитный дипольный момент электрона Магнитный момент электрона , обусловленный внутренними свойствами его спина и электрического заряда , равен примерно −9,284764 × 10 −24 джоулей на тесла . электронное нейтрино электронная пара Два электрона , которые занимают одну и ту же молекулярную орбиталь , но имеют противоположные спины . Электронные пары образуют химические связи или встречаются в виде одинарных пар валентных электронов ; также возможно, что электроны встречаются по отдельности в виде неспаренных электронов . электронная оболочка Орбиталь вокруг ядра атома , содержащая фиксированное количество электронов (обычно два или восемь). электроотрицательность (χ )Химическое свойство, описывающее тенденцию атома притягивать к себе общую пару электронов (или электронную плотность ). На электроотрицательность атома влияет как его ядерный заряд (который пропорционален количеству протонов в его ядре ), так и количество и расположение электронов в его атомных оболочках (что влияет на расстояние от ядра до валентных электронов ). Чем выше электроотрицательность атома или заместителя , тем сильнее он притягивает к себе электроны. Как правило, электроотрицательность — это свойство не отдельного атома, а атома в составе молекулы . Поэтому она зависит от химического окружения элемента, хотя обычно считается передаваемым свойством . электронвольт (эВ) электрофил Любой атом или молекула, которые могут принять электронную пару . Большинство электрофилов имеют суммарный положительный заряд , включают в себя атом с частичным положительным зарядом или нейтральный атом, у которого нет полного октета электронов, и поэтому они притягивают богатые электронами области других веществ; электрофил с вакантными орбиталями может принять электронную пару, предоставленную нуклеофилом , создавая химическую связь между двумя веществами. Поскольку они принимают электроны, электрофилы по определению являются кислотами Льюиса . электросинтез элемент Вид атомов , имеющих одинаковое количество протонов в своих атомных ядрах и, следовательно, одинаковое атомное число . Химические элементы составляют всю обычную материю во Вселенной; было идентифицировано 118 элементов, которые классифицированы по различным химическим свойствам в периодической таблице элементов . элементарная реакция Любая химическая реакция , в которой один или несколько химических веществ вступают в непосредственную реакцию с образованием продуктов за один этап реакции и с одним переходным состоянием , то есть без каких-либо промежуточных соединений . В отличие от пошаговой реакции . элюирование Процесс извлечения одного материала из другого путем промывки растворителем . Процесс элюирования заключается в пропускании раствора, содержащего анализируемый материал , мимо матрицы с адсорбентом , предназначенной для избирательного связывания молекул анализируемого вещества, и последующей промывке комплекса адсорбент/анализируемый растворитель, известный как элюент . Молекулы растворителя вытесняют анализируемый материал, связываясь с адсорбентом на его месте, позволяя выводить анализируемый материал, который теперь является частью элюата , из комплекса в коллектор для анализа. эмпирическая формула Наименьшее целое число, на которое делятся атомы каждого элемента , присутствующего в химическом соединении . эмульсия Тип коллоида , в котором мелкие частицы одной жидкости диспергированы в другой жидкости; например, дисперсия воды в масле или масла в воде. Эмульсии часто стабилизируются добавлением вещества, известного как эмульгатор , в молекулах которого есть как лиофильные, так и лиофобные части. [ 3 ] энантиомер энантиоморф конечная группа Конституционная единица , которая занимает конечное положение внутри или на конце макромолекулы или полимера и, таким образом, по определению связана только с одной другой конституционной единицей молекулы. [ 2 ] эндотермический процесс энергия Способность системы выполнять работу . полный Смотрите количество вещества . энтальпия Мера общей внутренней энергии термодинамической системы, обычно обозначаемая H . энтальпия плавления энтропия Количество энергии, недоступное для работы в замкнутой термодинамической системе, обычно обозначается S . химия окружающей среды фермент Биологический белковый катализатор , ускоряющий химическую реакцию. эпимер Трубка Эппендорфа Обобщённое и зарегистрированное название, используемое для обозначения микроцентрифужной пробирки . уравнение состояния равновесие Состояние системы, в котором все конкурирующие воздействия сбалансированы. Химическое равновесие — это состояние, при котором концентрации реагентов и продуктов в реагирующей системе перестают изменяться с течением времени. эквимолярный При равном количестве молей или растворов с одинаковой молярной концентрацией . Колба Эрленмейера эфир Класс органических и неорганических соединений, полученных в результате реакции кислоты со спиртом , в которой по крайней мере одна гидроксильная группа (–OH) заменяется алкоксильной группой (–O–). Сложные эфиры имеют общую формулу RCO 2 R′, где R и R′ представляют собой любую алкильную или арильную группу. эфир Класс органических соединений и функциональная группа , содержащая атом кислорода , связанный с двумя алкильными или ариловыми группами, которые могут быть одинаковыми или разными. Эфиры имеют общую формулу R–O–R′, где R и R′ представляют собой алкильные или арильные группы. этиловый Алкильная функциональная группа , образованная из этана , состоящая из двух атомов углерода, ковалентно связанных друг с другом и полностью насыщенных связями с атомами водорода, с химической формулой – CH 2 CH 3 . Это распространённый заместитель во многих органических соединениях, хотя он может существовать и самостоятельно в виде иона или радикала. В номенклатуре ИЮПАК наличие этильного заместителя может быть указано префиксом «этил» в названии соединения или аббревиатурой «Et» в химических формулах; например, этиловый спирт (этанол), который часто записывается формулой CH 3 CH 2 OH или EtOH . эвтектическая смесь Твёрдый раствор , состоящий из двух или более веществ, которые в совокупности имеют самую низкую температуру плавления среди всех возможных смесей этих компонентов. [ 3 ] испарение экзотермический процесс обширная собственность Физическая величина , значение которой пропорционально размеру системы, которую она описывает, или количеству вещества в системе. Примеры: масса , объём , энтальпия и энтропия . В отличие от интенсивных свойств . извлечение 1. Процесс разделения, при котором компонент отделяется от смеси путём избирательной растворимости . [ 3 ] См. также разделение . 2. Отделение компонента анализируемого вещества от матрицы . внешнее свойство


семья Смотрите группу . Постоянная Фарадея ( F ) Единица электрического заряда , широко используемая в электрохимии , равная отрицательному молярному заряду (электрическому заряду на моль) электронов . Она равна примерно 96 500 кулонам на моль ( Ф = 96 485 .332 12 ... Кл/моль ). Законы электролиза Фарадея Набор из двух законов, относящихся к электролизу , согласно которым: а) масса вещества, изменённого на электроде во время электролиза, прямо пропорциональна количеству электричества, переданного на этот электрод; и б) масса элементарного вещества, изменённого на электроде, прямо пропорциональна эквивалентной массе этого элемента. f-блок Законы распространения Фика фильтрация Любая физическая, биологическая или химическая операция, которая отделяет крупные частицы (часто твердое вещество) от более мелких частиц (часто жидкости) путем пропускания смеси через сложную решетчатую структуру, через которую могут проходить только частицы достаточно малого размера, называется фильтром . Жидкость и мелкие частицы, которые успешно проходят через фильтр, называются фильтратом . огневая точка Самая низкая температура , при которой пары над летучим веществом будут продолжать гореть в течение как минимум пяти секунд после воспламенения от открытого пламени стандартного размера. [ 8 ] Температуру воспламенения не следует путать с температурой вспышки , которая немного ниже и при которой вещество воспламеняется на короткое время, но при которой не образуется пар в количестве, достаточном для устойчивого горения. реакция первого порядка температура вспышки Самая низкая температура , при которой пары над летучим материалом будут воспламеняться при наличии источника воспламенения. Температуры вспышки, применение открытого огня вызывает лишь кратковременное "Флэш", а не устойчивое горение, для которых температура окружающей среды слишком низкая. Вспышка не следует путать с точка возгорания , который возникает при несколько более высокой температуре, ни при температуре воспламенения , которая еще выше. фляжка Сосуд или контейнер, чаще всего представляющий собой разновидность стеклянной посуды , широко используемой в лабораториях для различных целей, таких как приготовление, хранение, содержание, сбор и измерение объёма химических веществ, образцов или растворов, а также в качестве камеры, в которой происходит химическая реакция . Колбы бывают разных форм и размеров, но обычно характеризуются относительно широким нижним корпусом, который сужается в одну или несколько более узких трубчатых секций с отверстием наверху. флокуляция Процесс, при котором дисперсные частицы в коллоиде выходят из суспензии и объединяются в более крупные скопления, известные как хлопья или флоккулы , либо спонтанно, либо в результате добавления осветляющего агента . Этот термин часто используется для обозначения обратимой агрегации, при которой силы, удерживающие частицы вместе, слабы, и коллоид можно снова диспергировать с помощью перемешивания. [ 3 ] Флорентийская фляжка Смотрите колба для кипячения . официальное обвинение (FC) Электрический заряд присвоенный атом в молекула , при условии, что все электроны во всех облигации равномерно распределяются между атомами, независимо от относительного каждого атома электроотрицательность . Формальный заряд любого атома, входящего в состав молекулы, можно вычислить по формуле , где — количество валентных электронов нейтрального атома в его основном состоянии ; — количество валентных электронов атома, которые не участвуют в образовании связей в молекуле; и — количество электронов, участвующих в образовании связей с другими атомами в молекуле. масса рецептуры (FW) Синоним молярной массы и молекулярной массы , часто используемый для немолекулярных соединений, таких как ионные соли . дробь фракционная дистилляция Фракционирование смеси жидкостей на составные части или фракции в процессе дистилляции , обычно с использованием длинной вертикальной колонки, прикрепленной к дистилляционному сосуду и заполненной стеклянными шариками. Смесь нагревают до температуры, при которой одно или несколько компонентов начинают испаряться ; пар поднимается вверх по колонне, пока не конденсируется и не стекает обратно в сосуд, создавая температурный и волластовый градиент и позволяя отбирать различные фракции в разных точках по длине колонны. [ 3 ] Этот метод, распространенный в промышленной химии , достаточно чувствителен, чтобы разделять соединения, точки кипения которых отличаются друг от друга менее чем на 25 °C (45 °F) при стандартном давлении. фракционирование Процесс разделения, при котором определённое количество смеси во время фазового перехода разделяется на несколько меньших количеств, известных как фракции , химический состав которых изменяется в соответствии с градиентом. Фракционирование использует едва заметные различия в некоторых конкретных свойствах (например, массе , температуре кипения , растворимости и т. д.) между компонентами смеси, соединениями , что позволяет одновременно выделить более двух компонентов смеси. Существует множество разновидностей фракционирования, используемых во многих областях науки и техники. свободный радикал Видеть радикальный . сублимационная сушка Смотрите лиофилизация . замораживание Фазовый переход вещества из жидкого состояния в твёрдое . точка замерзания Температура при которой вещество меняет состояние с жидкого на твердое . Поскольку замораживание происходит в обратном порядке по сравнению с плавлением , температура замерзания вещества идентична его температуре плавления , но по общему правилу только температура плавления упоминается как характерное свойство вещества. снижение температуры замерзания частота Измерение количества циклов заданного процесса за единицу времени. Единицей измерения частоты в системе СИ является герц (Гц), где 1 Гц = 1 цикл в секунду. функциональная группа гальванический элемент Тип батареи , состоящей из электрохимических элементов с двумя разными металлами, соединёнными солевым мостиком . газ Одно из четырёх фундаментальных состояний материи , характеризующееся частицами высокой энергии, которые заполняют свой контейнер, но не имеют определённой формы или объёма. газовая хроматография Разновидность хроматографии , обычно используемая в аналитической химии для выделения и анализа химических соединений, которые можно испарить без разложения . Газовая хроматография часто используется для проверки чистоты веществ, идентификации неизвестных веществ и измерения относительного количества различных компонентов смесей . gauche В стереохимии алканов , структурная конформация , включающая угол кручения , равный ± 60°, или синклинальное расположение функциональных групп, присоединенных к соседним атомам. [ 2 ] Закон Гей-Люссака Химический закон, используемый для каждого из двух соотношений, выведенных французским химиком Жозефом Луи Гей-Люссаком и касающихся свойств газов, хотя это название чаще применяется к его закону объёмных отношений. геохимия Изучение химии и химического состава Земли и геологических процессов. Энергия Гиббса Значение, указывающее на спонтанность реакции. Обычно обозначается как G . стекло гликоль Любой из класса алифатических двухатомных спиртов , в которых две гидроксильные группы связаны с двумя разными атомами углерода, которые обычно, но не обязательно, находятся рядом друг с другом; например, этиленгликоль ( HOCH 2 CH 2 OH ). [ 2 ] грамм (г) грамм-атом Прежний термин, обозначавший крота . - Реакция Гриньяра
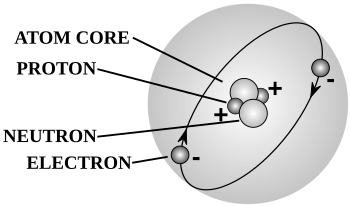
соединение отшлифованного стекла Устройство, предназначенное для быстрой и лёгкой стыковки двух герметичных стеклянных изделий, с шлифованными поверхностями и, как правило, изготовленное на заказ с коническим сужением. основное состояние Наименьшее возможное энергетическое состояние для данной квантово-механической системы, при котором энергия Гиббса фактически или теоретически минимизирована. Любая энергия, которая остаётся в системе в её основном состоянии, называется энергией нулевых колебаний . [ 2 ] Противоположность возбуждённому состоянию . Группа Вертикальный столбец периодической таблицы элементов и элементы, которые его образуют. В противоположность периоду . адрон Субатомная частица, в том числе барионы и мезоны , которая может участвовать в сильном взаимодействии. галоген Любой из пяти неметаллических элементов 17-й группы периодической таблицы : фтор (F), хлор (Cl), бром (Br), йод (I) и астат (At). жесткая кислота Кислота Льюиса с электроноакцепторным центром, который лишь слабо поляризуем . Твердые кислоты также, как правило, имеют высокие зарядовые состояния и относительно небольшие атомные ядра, в отличие от мягких кислот . [ 2 ] жесткая вода Вода с очень высоким содержанием минералов , как правило, образуется, когда вода просачивается через отложения, богатые кальцием , магнием и некоторыми другими катионами металлов. тепло Энергия передается от одной системы к другой путем теплового взаимодействия. теплота плавления Смотрите энтальпия плавления . теплота испарения См. энтальпия испарения . тяжелая вода Закон Генри Закон суммирования постоянной теплоты Гесса Закон физической химии , согласно которому общее изменение энтальпии в ходе химической реакции одинаково независимо от того, протекает ли реакция в один или несколько этапов. Правила Хунда гидратировать Любое вещество, содержащее воду или её составные элементы, или любое соединение , образованное путём добавления воды или её элементов к другой молекуле. реакция гидратации гидрид углеводороды водород водородная связь Форма электростатического взаимодействия между электроотрицательным атомом и атомом водорода , связанным со вторым электроотрицательным атомом. Водородная связь уникальна, поскольку малый размер атомов водорода позволяет сблизить взаимодействующие электрические заряды и может возникать как межмолекулярная или внутримолекулярная сила. гидрирование Любая химическая реакция между молекулярным водородом ( H 2 ) и другим химическим веществом, которая обычно приводит к восстановлению или насыщению другого вещества путём добавления одной или нескольких пар атомов водорода к соединению или элементу. Для протекания реакций гидрирования обычно требуется наличие катализатора ; некаталитическое гидрирование происходит только при экстремальных температурах. гидролиз Разрыв химической связи при добавлении воды . гидрон ( H + ) Катионная форма атомарного водорода , то есть положительно заряженное водородное ядро любого изотопного состава. Таким образом, этот термин может относиться к протону ( 1 1 H + ), дейтрон ( 2 1 H + ), или тритон ( 3 1 Час + ). водный Имеющий или содержащий молекулы воды , особенно воды гидратации . В противоположность безводному . гидроксид Двухатомный анион , состоящий из атома водорода, ковалентно связанного с атомом кислорода, имеющий общий отрицательный заряд, с химической формулой OH − ; или любой представитель класса органических и неорганических соединений, содержащих гидроксильную группу , например гидроксид натрия ( NaOH ). [ 4 ] гидрокси гигроскопия идеальный газ Гипотетический газ , состоящий из множества хаотично движущихся точечных частиц, которые не участвуют ни в каких межчастичных взаимодействиях, что делает математически удобным описание и прогнозирование их поведения при изменении переменных состояния . Концепция идеального газа полезна, поскольку он подчиняется закону идеального газа и может быть проанализирован в рамках статистической механики . постоянная идеального газа Константа пропорциональности в законе идеального газа , равная 0,08206 Л · атм /( К · моль ). закон идеального газа Уравнение состояния гипотетического идеального газа , которое гласит, что объём такого газа пропорционален количеству газа и его температуре шкале Кельвина , а также обратно пропорционален его давлению . Зако н идеального газа объединяет закон Бойля , закон Шарля , закон Гей-Люссака и закон Авогадро в одно уравнение, которое обычно формулируется как , где — постоянная идеального газа . Взаи мосвязи между переменными состояния, описанные в этом уравнении, являются хорошим приближением к поведению многих газов в широком диапазоне условий, хотя и имеют некоторые ограничения. идеальное решение Раствор , в котором газовая фаза обладает термодинамическими свойствами, аналогичными свойствам смеси идеальных газов . индикатор Специальное соединение, добавляемое в раствор , которое меняет цвет в зависимости от кислотности раствора. Разные индикаторы имеют разные цвета и эффективны в разных диапазонах pH . индуцированная радиоактивность Радиоактивность , вызванная бомбардировкой стабильного изотопа элементарными частицами, образующими нестабильный радиоактивный изотоп. инертный (о химическом веществе) Стабильное и химически инертное; [ 2 ] или термодинамически нелабильное , разлагающееся с низкой или незначительной скоростью. Примерами инертных веществ являются благородные газы , которые стабильны в своих природных формах, потому что их внешние электронные оболочки заполнены максимально возможным количеством электронов, что делает их устойчивыми к потере или приобретению электронов. неорганическое соединение Любое химическое соединение , не содержащее углерода , хотя есть и исключения. В отличие от органических соединений . неорганическая химия Раздел химии, изучающий химические свойства и реакции неорганических соединений . В отличие от органической химии . нерастворимость Неспособность вещества ( растворенного вещества ) образовывать раствор при растворении в другом веществе ( растворителе ); противоположность растворимости . вдохновение Процесс сгущения жидкости любым способом обезвоживания , особенно выпаривания . [ 4 ] изолятор Любой материал, препятствующий прохождению электрического тока . В отличие от проводника . интенсивное свойство Физическая величина , значение которой не зависит от размера системы или количества вещества , для которого она измеряется. Примеры: плотность , температура и давление . В отличие от экстенсивного свойства . интерфейс Граница между двумя пространственными областями, занятыми различными веществами , особенно веществами в разных фазах или физических состояниях . См. также поверхность и фазовая граница . промежуточный См. реактивный промежуточный продукт . интерметаллический Тип сплава , который образует упорядоченное твёрдое соединение между двумя или более металлическими элементами. Интерметаллические соединения обычно твёрдые и хрупкие и обладают полезными механическими свойствами при высоких температурах. межмолекулярная сила Любая сила, которая обеспечивает взаимодействие между молекулами , например, электромагнитные силы притяжения или отталкивания, водородные связи и ван-дер-ваальсовы силы , которые действуют между атомами одной молекулы и атомами или ионами соседних молекул. Межмолекулярные силы слабы по сравнению с внутримолекулярными силами , такими как ковалентные связи , которые удерживают отдельные молекулы вместе. Международная система единиц (СИ) Международный союз теоретической и прикладной химии (IUPAC) Международная федерация химиков, признанная мировым авторитетом в разработке стандартов химической номенклатуры и других методик в химии. промежуточное соединение Соединение , состоящее из переходного металла , связанного с водородом, бором , углеродом или азотом , кристаллическая структура которого состоит из плотно упакованных ионов металла с неметаллическими атомами, расположенными в промежутках. [ 4 ] внутримолекулярная сила внутреннее свойство ион Молекула , которая приобрела или потеряла один или несколько электронов по сравнению со своим нейтральным состоянием и поэтому обладает отрицательным или положительным электрическим зарядом . ионная связь Электростатическое притяжение между противоположно заряженными ионами . ионная сила Показатель концентрации ионов в растворе , обычно выражаемый в молярности (моль/л раствора) или моляльности (моль/кг растворителя). [ 9 ] ионизация Расщепление химического соединения на отдельные ионы . изоэлектронность Явление, при котором два или более химических вещества ( атомы , молекулы , ионы и т. д.) состоят из разных элементов , но имеют одинаковое количество валентных электронов и одинаковую структуру (т. е. одинаковое количество атомов с одинаковой связью). Изоэлектронные вещества обычно демонстрируют полезную согласованность и предсказуемость своих химических свойств. изомеризация изомеры Ионы или молекулы с одинаковыми химическими формулами , но разными структурами или пространственным расположением. Изомеры не обязательно обладают схожими свойствами. Два основных типа изомеров — структурные изомеры и стереоизомеры . изотоп Вариант конкретного химического элемента , отличающийся количеством нейтронов в ядре . Все изотопы одного элемента имеют одинаковое количество протонов в каждом атоме . джоуль (Дж) Единица СИ измерения энергии (обозначение: Дж). Один джоуль определяется как один ньютон - метр . кельвин (K) Единица СИ измерения температуры (обозначение: К). Шкала Кельвина — это абсолютная шкала термодинамической температуры , в которой абсолютный ноль является нулевой точкой. кетокислота Любое органическое соединение, которое можно классифицировать как кетон и карбоновую кислоту благодаря наличию кето -группы и карбоксильной группы. [ 4 ] кетон Класс органических соединений и функциональная группа , состоящая из карбонильной группы между двумя атомами углерода . Кетоны имеют общую формулу R 2 C=O, где R может быть любым углеродсодержащим заместителем . точка розжига Смотрите Температуру самовоспламенения . кинетика Раздел химии, специализирующийся на изучении скоростей реакций . кинетическая энергия Энергия объекта, обусловленная его движением. лабильность лантаноиды Периодическая таблица металлических элементов с атомными номерами от 57 до 71, от лантана до лютеция . решетка Уникальное геометрическое расположение атомов или молекул в кристаллической жидкости или твёрдом теле. энергия решетки Энергия, высвобождающаяся при образовании одного моля кристаллического ионного соединения из составляющих его ионов, которые изначально находятся в газообразном состоянии. Энергия кристаллической решётки может рассматриваться как мера сил сцепления, связывающих ионные твёрдые тела; поэтому она напрямую связана со многими другими физическими свойствами твёрдого тела, включая растворимость , твёрдость и летучесть . закон сохранения энергии закон сохранения массы закон множественных пропорций законы термодинамики эффект выравнивания Влияние растворителя на химические свойства кислот или оснований , растворённых в нём. Сила сильной кислоты ограничивается или «выравнивается» основностью растворителя, и аналогично сила сильного основания ограничивается кислотностью растворителя, так что эффективный pH раствора выше или ниже, чем можно было бы предположить по константе диссоциации кислоты или основания. Кислота Льюиса База Льюиса Структура Льюиса лиганд Ион , функциональная группа или другая молекула , которая связывается с центральным атомом металла , образуя координационный комплекс . Такая связь может быть как ковалентной , так и ионной , но обычно предполагает формальное предоставление одной или нескольких электронных пар лиганда металлу. свет Часть электромагнитного спектра , видимая невооружённым глазом. сжижение Любой процесс, в результате которого жидкость образуется из твёрдого или газообразного вещества, или в результате которого образуется нежидкая фаза, которая ведёт себя как жидкость . точка сжижения Смотрите температуру плавления . жидкий Одно из четырёх фундаментальных состояний материи , характеризующееся почти несжимаемыми частицами жидкости, которые сохраняют определённый объём, но не имеют фиксированной формы. жидкостно–жидкостная экстракция (LLE) локатор Лондонские силы рассредоточения Разновидность слабого межмолекулярного взаимодействия . макромолекула Очень большая молекула , состоящая из множества атомов и связей , или любая молекула с высокой относительной молекулярной массой , особенно та, структура которой образована многократным повторением дискретных субъединиц, полученных фактически или концептуально из молекул с низкой относительной молекулярной массой (например, мономеров , заместителей и функциональных групп ). Этот термин часто используется как синоним полимера . [ 2 ] магнитное квантовое число податливость См. пластичность . манометр Прибор для измерения давления , изобретённый Эванджелистой Торричелли в 1643 году. маскирующее средство Реагент , используемый в химическом анализе , который вступает в реакцию с одним или несколькими другими химическими веществами , которые могут помешать анализу. масса Свойство физической материи , которое является мерой её сопротивления ускорению при приложении суммарной силы . Единицей измерения массы в СИ является килограмм (кг). массовая концентрация массовая доля массовое число ( A ) Общее количество протонов и нейтронов (вместе известных как нуклоны ) в ядре атома . Оно определяет атомную массу атома. Массовое число варьируется у разных изотопов одного и того же химического элемента и часто указывается либо после названия элемента (как в углероде-12), либо в виде верхнего индекса слева от символа элемента (как в 12 C ) для обозначения конкретного изотопа. масс-спектрометрия (МС) Аналитический метод, который измеряет отношение массы к заряду ионов в химическом образце путём бомбардировки образца электронами до ионизации , а затем разделения заряженных фрагментов с помощью электрического или магнитного поля, как правило, для определения элементного или изотопного состава неизвестного вещества, масс составляющих его частиц и/или идентичности или структуры молекул в его составе. Результаты представлены в виде масс-спектра — графика зависимости интенсивности ионных сигналов от отношения массы к заряду. материя Любое вещество, обладающее массой и занимающее пространство, имеет объём . Металлические Любой химический элемент, который является хорошим проводником как электричества , так и тепла и который легко образует катионы и ионные связи с неметаллами . тающий Фазовый переход вещества из твёрдого состояния в жидкое . температура плавления Температура , при которой вещество меняет состояние с твердого состояния на жидкое . Это зависит от давления и обычно указывается для данного вещества в стандартных условиях . Температура плавления вещества идентична его температуре замерзания . меркаптан См. тиол . меркапто - См. тиол.
металлоид Химический элемент или вещество , обладающее свойствами как металлов , так и неметаллов . метамер См. изомер . метатезис
{% raw %}Класс химических реакций, включающих обмен элементами или функциональными группами между двумя или более соединениями, как описано в общем уравнении . [ 4 ] Примеры включают метатезис алканов , метатезис алкинов , метатезис олефинов и реакцию метатезиса солей . См. также двойное замещение . метиловый Алкильная функциональная группа , образованная из метана , состоит из одного атома углерода, связанного с тремя атомами водорода, и имеет химическую формулу CH 3 . Это простейший углеводород , который встречается в качестве заместителя во многих органических соединениях, хотя может существовать и самостоятельно в виде иона или радикала. В номенклатуре ИЮПАК наличие метильного заместителя обозначается префиксом метил в названии соединения или аббревиатурой Me в химических формулах; например, метиловый спирт (метанол) часто обозначается формулой CH 3 OH или MeOH . метиленовый синий A гетероциклический ароматный соединение с помощью молекулярная формула C 16H 18N 3S Cl .микроцентрифужная трубка Небольшой пластиковый герметичный контейнер, который используется для хранения небольших объёмов жидкости, обычно менее 2 миллилитров. минерал Твёрдое химическое соединение с довольно чётко определённым химическим составом и специфической кристаллической структурой , встречающееся в природе в чистом виде. [ 10 ] смешиваемость Склонность или способность двух или более веществ равномерно смешиваться при соединении (чаще всего жидкостей, хотя это понятие применимо и к твёрдым веществам, и к газам), то есть растворяться друг в друге, образуя однородную смесь , которая существует в одной фазе , без разделения на фазы, независимо от пропорций каждого вещества. Вещества, которые не смешиваются равномерно во всех пропорциях, называются несмешивающимися . [ 4 ] [ 2 ] смесь Материал, состоящий из двух или более различных веществ, которые смешиваются физически, но не вступают в химическую реакцию (то есть не происходит химической реакции, в результате которой молекулы одного вещества превращаются в молекулы другого вещества). фрагмент Любая названная характерная группа, ветвь или другая часть большой молекулы , которую можно идентифицировать и в других видах молекул. Функциональные группы обычно меньше и более универсальны, чем фрагменты, в то время как заместители и боковые цепи часто можно классифицировать как фрагменты, и наоборот. молярная концентрация Показатель концентрации растворённого вещества в растворе в пересчёте на количество растворённого вещества на единицу массы растворителя . Моляльность обычно выражается в молях на килограмм (моль/кг); о растворе с концентрацией ровно 1 моль/кг иногда говорят, что он 1 моляльный . В отличие от молярности . молярный коэффициент затухания молярная концентрация Показатель концентрации химического вещества , особенно растворённого вещества в растворе , выраженный в количестве вещества на единицу объёма раствора. Молярная концентрация обычно выражается в молях на литр (моль/л); раствор с концентрацией ровно 1 моль/л обычно называют одномолярным , сокращённо 1 М . Сравните с моляльностью . молярная доля молярная масса Для данного химического соединения масса образца этого соединения, делённая на количество соединения в образце, обычно выражается в граммах на моль (г/моль). Молярная масса как объёмное свойство — это среднее значение масс многих экземпляров соединения, каждая из которых может незначительно отличаться из-за наличия изотопов атомов, входящих в состав соединения. Обычно она рассчитывается на основе молекулярной массы соединения, которая, в свою очередь, представляет собой сумму стандартных атомных масс входящих в состав атомов и, следовательно, зависит от относительной распространённости изотопов в природе. Молярная масса позволяет легко переводить массу в количество молей при рассмотрении больших объёмов вещества. молярность Смотрите молярную концентрацию . моль (mol) Единица измерения (обозначается как моль), используемая для измерения количества вещества в единицах абсолютного числа частиц или объектов, составляющих вещество. По определению, один моль любого вещества содержит ровно число Авогадро (то есть 6,022 × 10 23 ) частиц или объектов. молекулярная формула молекулярная орбиталь (MO) Любая область, в которой один или несколько электронов могут находиться в молекуле (в отличие от отдельного атома ). молекулярная орбитальная диаграмма молекулярная масса (МВТ) молекула Ряд атомов , которые химически связаны между собой и в совокупности являются электрически нейтральными. одноатомный Состоит только из одного атома , в отличие от молекулы , состоящей более чем из одного атома. Практически все элементы являются одноатомными в газообразной фазе при достаточно высоких температурах. Сравните двухатомные и многоатомные элементы. естественное изобилие аккуратный Условия с использованием жидкого реагента или газа без добавления растворителя или сорастворителя. нейтрон Тип субатомной частицы , которая является электрически нейтральной и не имеет суммарного заряда. азот благородный газ Любой из шести неметаллических элементов 18-й группы периодической таблицы : гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радон (Rn). Все благородные газы имеют внешние электронные оболочки , которые в их естественном состоянии полностью заполнены валентными электронами , что обеспечивает им очень низкую или практически нулевую химическую активность . неметаллический Любой химический элемент, который не является металлом . неполярное соединение Соединение , состоящее из ковалентных молекул без постоянного дипольного момента . [ 3 ] В отличие от полярного соединения . нормальность ядерный Из атомного ядра или относящийся к нему. ядерная химия Раздел химии, изучающий различные процессы и свойства, связанные с атомными ядрами , включая радиоактивность . спектроскопия ядерного магнитного резонанса Метод, использующий магнитные свойства определённых атомных ядер, полезен для идентификации неизвестных соединений. Ядерный магнитный резонанс часто сокращают до ЯМР . ядерная трансмутация нуклон Либо протон , либо нейтрон , рассматриваемые как компоненты атомного ядра . нуклеофил Любой атом или молекула, которые могут отдать электронную пару другому атому или молекуле. Все молекулы или ионы со свободной парой электронов или хотя бы с одной пи-связью могут выступать в качестве нуклеофилов, притягиваясь к дефицитным по электронам участкам других веществ. Химическая реакция, в которой нуклеофил отдаёт электронную пару электрофилу , может называться нуклеофильной атакой . Поскольку нуклеофилы отдают электроны, они по определению являются основаниями Льюиса . ядро Центр атома , состоящий из нейтронов и протонов и обладающий суммарным положительным электрическим зарядом. нуклид Вид атома , характеризующийся массовым числом , атомным номером и состоянием ядерной энергии, при условии, что средняя продолжительность жизни в этом состоянии достаточно велика, чтобы её можно было наблюдать. числовая плотность Показатель концентрации подсчитываемых объектов (атомов, молекул и т. д.) в пространстве, выраженный в количестве на единицу объёма . правило октета Классическое правило для описания электронной конфигурации атомов в определённых молекулах: максимальное количество электронных пар , которые могут находиться на валентной оболочке элемента в первом ряду периодической таблицы , равно четырём (или восьми в общей сложности). Для элементов во втором и последующих рядах существует множество исключений из этого правила. олефин Тривиальное (не- IUPAC ) название для любого алкена . оптическая активность орбитальный Любая область атома или молекулы, в которой можно обнаружить один или несколько электронов . Этот термин может относиться как к атомной орбитали , так и к молекулярной орбитали . орбитальная гибридизация порядок реакции органическая кислота Любое органическое соединение , обладающее кислотными свойствами. Противоположность органическому основанию . органическая основа Любое органическое соединение с основными свойствами. В отличие от органической кислоты . органическая химия Раздел химии, изучающий химические свойства и реакции органических соединений . В отличие от неорганической химии . органическое соединение Любое химическое соединение , содержащее один или несколько атомов углерода . В отличие от неорганических соединений . органическая окислительно-восстановительная реакция сероорганическое соединение Любое химическое соединение , содержащее атомы углерода и серы . [ 4 ] осмоль осмос Самопроизвольное направленное движение или диффузия молекул растворителя (например, воды ) через полупроницаемую мембрану , разделяющую два раствора с разной концентрацией растворённых веществ , в направлении, которое стремится уравнять концентрации растворённых веществ с обеих сторон, то есть от более разбавленного раствора к более концентрированному, или, что то же самое, от области с высоким водным потенциалом к области с низким водным потенциалом. Поскольку растворённое вещество не может пройти через мембрану, стремление к равновесию заставляет растворитель проходить через мембрану вместо него. Это продолжается до тех пор, пока не будет достигнуто равновесие, при котором ни одна из сторон мембраны не будет более или менее концентрированной, чем другая. осмотическая концентрация осмотическое давление другой металл Любой из металлических элементов в p-блоке , для которых характерно сочетание относительно низких температур плавления (все ниже 950 К) и относительно высоких значений электроотрицательности (все выше 1,6 по шкале Полинга). окисление Увеличение степени окисления химического вещества в окислительно-восстановительной реакции, как правило, за счёт потери электронов . Противоположно восстановлению . степень окисления 1. Степень окисления отдельного атома в химическом соединении, измеряемая как уменьшение количества электронов по сравнению с естественным элементарным состоянием атома. 2. Гипотетический электрический заряд (положительный, отрицательный или нулевой), который был бы у атома, если бы все связи с атомами других элементов были на 100% ионными , без ковалентной составляющей. окисляющий агент 1. Химическое вещество, которое получает или принимает один или несколько электронов от другого вещества, называемого восстановителем , в окислительно-восстановительной реакции, тем самым вызывая окисление другого вещества и, в свою очередь, подвергаясь восстановлению . Степень окисления окислителя уменьшается, а восстановителя увеличивается. [ 3 ] 2. Химическое вещество, которое переносит сильно электроотрицательные атомы , обычно кислород, на субстрат. оксокислота 1. Любая кислота , содержащая кислород в кислотной группе. 2. Любое соединение, содержащее кислород, по крайней мере один другой элемент и по крайней мере один атом водорода , связанный с кислородом, и образующее сопряжённое основание путём потери положительно заряженных протонов водорода. кислород p-блок парный электрон Один из двух электронов , которые вместе образуют валентную связь между двумя атомами . [ 4 ] В отличие от неспаренного электрона . парафин 1. Тривиальное (не- IUPAC ) название для любого алкана . 2. Другое название керосина . парциальное давление коэффициент разделения паскаль (Pa) пассивация Процесс нанесения на вещество тонкого слоя защитного материала, часто оксида металла , для создания защиты от коррозии или других химических реакций с окружающей средой, что делает покрытое веществом «пассивным» или менее восприимчивым к нежелательным реакциям. пассивность Состояние химической инертности, особенно металла , который относительно устойчив к коррозии из-за естественной или вызванной потерей химической активности (как при пассивации ). [ 4 ] См. также инертный . подвесная группа Ответвление или боковая цепь основной цепи полимерной молекулы, особенно если она сама по себе не является ни олигомерной, ни полимерной. [ 2 ] пятиосновный (в химическом соединении) имеет пять атомов водорода , которые могут быть заменены металлами или основаниями . [ 4 ] пятиокись Любое бинарное соединение , содержащее пять атомов кислорода, например пятиокись йода ( I 2 O 5 ). [ 4 ] пентил Алкильная функциональная группа , содержащая пять атомов углерода, с общей химической формулой – C 5 H 11 . Это заместительная форма алкана пентана . за- Префикс в химической номенклатуре ИЮПАК , означающий «полный», «исчерпывающий» или «экстремальный», как в случае с полностью замещённым углеводородом ; или указывающий на наличие пероксидной группы. [ 4 ] надкислотный Кислота , содержащая кислотную пероксидную группу ( –O–O– ); например, периодическая кислота . [ 4 ] период Горизонтальный ряд периодической таблицы элементов и элементы, которые его составляют. Контрастная группа . периодическая таблица элементов Табличное расположение химических элементов в соответствии с их атомным номером , электронной конфигурацией и другими химическими свойствами, структура которого показывает периодические закономерности и используется химиками для определения взаимосвязей между различными элементами, а также для прогнозирования свойств и поведения ещё не открытых или недавно синтезированных элементов. Первая периодическая таблица элементов была опубликована русским химиком Дмитрием Менделеевым в 1869 году. перекись 1. Класс соединений, содержащих пероксидную группу, имеющую общую структурную формулу R–O–O–R , где R — любой элемент или функциональная группа ; например, перекись водорода (эмпирическая H 2 O 2 , структурная H–O–O–H ). [ 4 ] 2. Другое название самой пероксигруппы. 3. Соль аниона O 2−
2.[2]перекись Функциональная группа , состоящая из двух атомов кислорода , непосредственно связанных друг с другом одинарной связью и каждый из которых также связан с другим атомом. Пероксиды имеют общую структурную формулу –O–O– . pH Логарифмическая шкала, используемая для определения кислотности или щелочности водного раствора . Шкала pH приблизительно соответствует отрицательному десятичному логарифму молярной концентрации ионов водорода в растворе. При комнатной температуре чистая вода является нейтральной (pH = 7); растворы с pH меньше 7 являются кислыми, а растворы с pH больше 7 — щелочными. фаза Область пространства, в которой все физические свойства вещества по сути одинаковы, или область материала, которая химически однородна, физически различима и часто может быть механически разделена. Термин «фаза» может иметь несколько значений в контексте химии; в разговорной речи он часто используется как синоним «состояния вещества» , но в пределах одного состояния вещества может существовать множество различных фаз. фазовая диаграмма Графическое представление равновесных соотношений между термодинамически различными фазами химического соединения, смеси или раствора, указывающее на физические условия (например, температуру и давление), при которых возникают или сосуществуют различные фазы (например, твёрдая , жидкая и газообразная ). [ 4 ] фазовый переход 1. Превращение химического вещества из твёрдого в жидкое и газообразное состояния вещества , а в редких случаях — в плазму . 2. Измеряемые значения внешних условий, при которых происходит такое преобразование. фенил Функциональная группа , состоящая из циклического кольца из шести атомов углерода с химической формулой –C 6 H 5 . Это заместительная форма циклоалкана бензола . фи - связь фотон Носитель электромагнитного излучения всех длин волн (таких как гамма-лучи и радиоволны ). физическая химия Раздел химии, изучающий химические системы с точки зрения принципов, методов и концепций физики , таких как движение, энергия, сила, время, термодинамика , химическое равновесие и статистическая механика, среди прочих. В отличие от химической физики , физическая химия — это преимущественно (хотя и не полностью) макроскопическая наука, изучающая физические и химические взаимодействия больших объёмов вещества. связь пи пипетка Лабораторный инструмент, широко используемый в химии, биологии и медицине для переноса и дозирования точно отмеренного объёма жидкости. плазма Одно из четырёх фундаментальных состояний материи , в котором частицы с очень высокой энергией частично или полностью ионизированы до такой степени, что демонстрируют уникальные свойства и поведение, нехарактерные для остальных трёх состояний. Плазма не существует в свободном виде на поверхности Земли в естественных условиях. пниктоген Любой из химических элементов , относящихся к пятой группе (V) периодической таблицы : азот (N), фосфор (P), мышьяк (As), сурьма (Sb), висмут (Bi) и московий (Ms). Эти элементы объединяет общая пятивалентность, то есть в неионизированном состоянии атомы этих элементов имеют ровно пять валентных электронов на внешней электронной оболочке , не дотягивая до полного октета на три электрона. полярность многоатомный Состоит из двух или более атомов одного или разных элементов. Сравните одноатомный и двухатомный . многоатомный ион Молекула , состоящая из двух или более ковалентно связанных атомов , которые в совокупности имеют суммарный электрический заряд и поэтому действуют как ионы . полимеризация Химическая связь двух или более отдельных молекул мономера для образования полимерной цепи или сети; или любая реакция, которая приводит к такой связи. [ 4 ] потенциальная энергия Энергия, запасённая в теле или системе в результате его положения в силовом поле или конфигурации. осадитель Химическое соединение или реагент , вызывающий химическую реакцию, в результате которой при добавлении к раствору образуется твёрдый осадок . [ 4 ] выпадать в осадок 1. (сущ.) Твёрдое вещество, которое отделяется от жидкого раствора или диффундирует из твёрдого сплава в процессе осаждения . [ 4 ] 2. (гл.) Отделяться от другого вещества, образуя отдельную конденсированную твёрдую фазу . атмосферные осадки Процесс образования отделимой твёрдой фазы в жидкой среде, например, путём преобразования растворённого вещества в перенасыщенном растворе в нерастворимое твёрдое вещество; или диффузия отдельной твёрдой фазы из твёрдого сплава . Реагент, вызывающий такую реакцию, называется осадителем , а само отделимое твёрдое вещество — осадком . [ 4 ] В более широком смысле этот термин может относиться к образованию любой новой конденсированной фазы путём изменения физических свойств системы (например, водяной пар конденсируется в капли жидкой воды). точность Насколько близки друг к другу результаты нескольких экспериментальных исследований или наблюдений. Сравните точность . давление Сила , приложенная перпендикулярно поверхности объекта на единицу площади . Единицей измерения давления в СИ является паскаль (Па), хотя в химии также часто используются многие другие единицы измерения давления. первичный Самая простая, наиболее известная или каноническая форма химического соединения с несколькими похожими или изомерными формами. Например, в первичном спирте углерод связан с одной заместительной группой ( R 1 CH 2 OH ), тогда как вторичный спирт является дважды замещённым ( R 1 R 2 CHOH ), а третичный спирт — трижды замещённым ( R 1 R 2 R 3 COH ). [ 4 ] пропил Алкильная функциональная группа , полученная из любого из двух изомеров пропана , с общей химической формулой – C 3 H 7 . Она может выступать в качестве заместителя в органических соединениях или существовать независимо в виде иона или радикала. В номенклатуре IUPAC наличие пропильного заместителя указывается с помощью префикса пропил в названии соединения или с помощью сокращения Pr в химических формулах; например, пропиловый спирт (пропанол) может встречаться в любой из двух изомерных форм, либо в линейном 1-пропаноле, либо в n -пропаноле , записанном как CH 3 CH 2 CH 2 OH , либо в разветвленном 2-пропаноле, либо в изопропиловый спирт , записанный (CH 3 ) 2 CHOH , и обе формы могут быть записаны с общей формулой PrOH . Третья, неизомерная, циклическая форма, известная как циклопропил , также иногда считается пропильной группой. защитная группа протический (о химическом веществе) Способное выступать в качестве протонного донора; легко генерирующее или выделяющее свободные протоны ( H + ) в растворе. Таким образом, протонные вещества можно считать сильно или слабо кислыми в смысле кислоты Бренстеда — Лоури . [ 2 ] протон Субатомная частица с положительным электрическим зарядом, которая находится в ядре атома . Часто обозначается символом H + . протонирование Добавление протона ( H + ) к атому, молекуле или иону. чистое вещество См. химическое вещество . пиролиз Термическое разложение материалов при повышенных температурах в инертной атмосфере, например в вакууме. квантовый квантовая механика Изучение поведения и структуры атомов, молекул, субатомных частиц и т. д. кварк Элементарная частица и фундаментальная составляющая материи. кистевидный Равномолярная смесь пары энантиомеров , которая не проявляет оптической активности . Химическое название или формула рацемата отличаются от названий или формул энантиомеров префиксом (±)- или символами RS и SR . излучение Энергия высвобождается в виде волн или субатомных частиц при переходе из состояния с высокой энергией в состояние с низкой энергией. радикальный Любой атом, молекула или ион, у которых есть хотя бы один неспаренный валентный электрон . За редким исключением, такие неспаренные электроны делают радикалы очень химически активными, поэтому органические радикалы обычно недолговечны. радиоактивный распад Процесс, при котором нестабильное атомное ядро теряет избыточную ядерную энергию, испуская излучение в одной из нескольких форм, включая гамма-излучение , альфа-частицы или бета-частицы , а также выбрасывая электроны со своих атомных орбиталей . радиохимия Раздел химии, изучающий радиоактивные вещества и радиоактивность , в том числе использование радиоактивных изотопов для изучения нерадиоактивных изотопов и обычных химических реакций. радионуклид Радиоактивный нуклид определённого элемента , особенно конкретный изотоп этого элемента, который характеризуется спонтанным распадом на один или несколько стабильных нуклидов путём излучения избыточной энергии из ядра. [ 2 ] Закон Рауля Закон термодинамики, согласно которому парциальное давление каждого газообразного компонента идеальной смеси жидкостей равно давлению пара чистого компонента, умноженному на его молярную долю в смеси. редкоземельный элемент Любой из 17 почти неотличимых друг от друга серебристо-белых, мягких, тяжёлых металлических элементов , входящих в ряд лантаноидов (с атомными номерами от 57 до 71), а также скандий и иттрий . уравнение скорости этап определения скорости Самый медленный этап химической реакции , состоящей из нескольких этапов. Скорость этого этапа определяет общую скорость реакции . [ 3 ] реагент Любое вещество, которое расходуется в ходе химической реакции . реакция Смотрите химическую реакцию . реакционный барьер Дефицит энергии, который необходимо преодолеть, чтобы конкретная химическая реакция произошла. В теории переходного состояния реакционный барьер интерпретируется как разница между энергией нулевой точки активированного комплекса , образующегося в ходе реакции, и энергией исходных реагентов . [ 2 ] См. также энергия активации . механизм реакции Поэтапная последовательность элементарных реакций , с помощью которых происходит более сложная химическая реакция или общее изменение. Полный механизм должен описывать и объяснять, какие связи разрываются и какие образуются (и в каком порядке), а также все задействованные реагенты , продукты и катализаторы ; количество каждого из них; все промежуточные соединения , активированные комплексы и переходные состояния ; а также стереохимию каждого химического соединения. Поскольку в большинстве случаев невозможно наблюдать за подробными процессами сложной реакции, механизм реакции часто представляет собой теоретическое предположение, основанное на термодинамической осуществимости и той небольшой поддержке, которую можно получить в результате эксперимента. скорость реакции Скорость, с которой реагенты превращаются в продукты в ходе химической реакции . постоянная скорость реакции реактивная связь Химическая связь между атомами, которая в определённом контексте является относительно нестабильной и поэтому легко разрывается или разрушается под воздействием других химических веществ или радикалов ; например, двойная связь в этилене ( CH 2 =CH 2 ) очень реакционноспособна в присутствии других молекул этилена, что приводит к реакции полимеризации , в результате которой образуется полиэтилен . [ 4 ] реактивный промежуточный продукт Любое короткоживущее, нестабильное, высокореакционноспособное химическое вещество , которое на короткое время образуется в результате химической реакции , но быстро вступает в дальнейшие реакции, превращающие его в более стабильное вещество. Таким образом, оно является промежуточным звеном между стабильными реагентами и продуктами общей реакции. Существование промежуточных веществ, если их можно обнаружить, имеет решающее значение для точного понимания механизма реакции . реактивность Склонность определённого химического вещества вступать в химическую реакцию как само по себе, так и с другими веществами, обычно относится к одному или обоим из двух отдельных наблюдений: вступает ли вещество в реакцию при определённых условиях и насколько быстро оно вступает в реакцию (то есть скорость реакции ). С точки зрения термодинамики , химическая реакция происходит потому, что продукты (взятые в совокупности) обладают более низкой свободной энергией , чем реагенты , и, следовательно, являются более энергетически «стабильными», но понятие реакционной способности может также включать кинетические факторы, в зависимости от контекста. Химическая стабильность и химическая совместимость — связанные, но разные понятия. ряд реактивности Эмпирическая, расчётная и структурно-аналитическая последовательность ряда металлов , расположенных в порядке возрастания их общей реакционной способности от высшей к низшей и используемых для обобщения информации об их реакциях с кислотами и водой, а также о методах их извлечения из руд. реагент 1. Другое название реагента . 2. Тестируемое вещество, которое добавляется в систему, чтобы вызвать химическую реакцию или проверить, происходит ли реакция. окислительно - восстановительный процесс восстанавливающий агент Химическое вещество, которое теряет или отдает один или несколько электронов другому веществу, называемому окислителем , в окислительно-восстановительной реакции, тем самым вызывая восстановление другого вещества и, в свою очередь, подвергаясь окислению . Степень окисления восстановителя увеличивается, а окислителя — уменьшается. [ 3 ] сокращение Уменьшение степени окисления химического вещества в окислительно-восстановительной реакции, как правило, за счёт присоединения электронов . Противоположно окислению . потенциал сокращения огнеупорный материал 1. Обладает высокой температурой плавления . [ 3 ] 2. Материал, устойчивый к разложению под воздействием тепла, давления или химических веществ, сохраняющий прочность и форму при высоких температурах и пригодный для использования в условиях, подверженных таким воздействиям. Огнеупоры обычно представляют собой поликристаллические, многофазные, неорганические , неметаллические, пористые и неоднородные соединения. резонанс возражать Лабораторный прибор, используемый для дистилляции или сухой перегонки химических веществ, традиционно состоит из сферического сосуда с длинным, направленным вниз горлышком, через которое конденсированные пары, образующиеся при дистилляции, поступают в отдельный сосуд для сбора. обратимая реакция Химическая реакция , которая может протекать в обоих направлениях в зависимости от условий реакции, то есть от реагентов к продуктам или от продуктов к реагентам, особенно если подразумевается, что оба превращения происходят одновременно. В противоположность необратимой реакции . вращатель колба с круглым дном Ржавчина s-образный блок Общее название элементов 1-й и 2-й групп периодической таблицы ( щелочей и щелочноземельных металлов ), а также водорода и гелия . физиологический раствор Общее название раствора хлорида натрия (NaCl), растворённого в воде (H 2 O). соль Любое ионное соединение , состоящее из одного или нескольких анионов и одного или нескольких катионов . соляной мост Устройство, используемое для соединения полуэлементов восстановления и окисления в электрохимической ячейке . насыщенность Schrödinger equation Квантовое уравнение состояния, которое представляет поведение электрона вокруг атома. мерцание Вспышка люминесценции кратковременного действия, возникающая при высвобождении энергии отдельной энергетически возбуждённой частицей. [ 2 ] реакция второго порядка полупроводник Электропроводящее твёрдое вещество, степень электропроводности которого находится где-то между проводником и изолятором . последовательное разбавление боковая цепь Химическая заместительная группа , присоединённая к основной части или « остову » более крупной молекулы , особенно олигомерной или полимерной углеводородной цепи, отходящей от более длинной первичной цепи макромолекулы . Э тот термин чаще всего встречается в биохимии и органической химии . одинарная связь Связь , которая предполагает совместное использование одной пары электронов . скелетная формула сол Суспензия твёрдых частиц в жидкости. К искусственным примерам относятся золь-гели . твердый Одно из четырёх фундаментальных состояний материи , характеризующееся относительно низкой энергией частиц, плотно упакованных в жёсткие структуры с определённой формой и объёмом. См. модуль Юнга . твердофазная экстракция (SPE) растворимость Свойство твёрдого , жидкого или газообразного растворённого вещества растворяться в твёрдом, жидком или газообразном растворителе . О бычно выражается как доля растворённого вещества, растворённого в растворителе в полностью насыщенном растворе . продукт растворимости ( или ) Мера растворимости ионного растворенного вещества , выраженная как арифметическое произведение концентраций его ионов в полностью насыщенном растворе с учетом конкретных равновесий диссоциации растворенного вещества и конкретных присутствующих ионов. Д ля равновесия диссоциации произведение растворимости ионного растворенного вещества , где и - концентрации ионных компонентов растворенного вещества в насыщенном растворе. П роизведение растворимости выводится из константы равновесия диссоциации и функционирует как константа равновесия, хотя, в отличие от константы равновесия, оно не является безразмерным. Е сли произведение концентраций ионов в растворе превышает произведение растворимости, то происходит осаждение . [ 3 ] растворенное вещество Часть раствора , которая растворена в растворителе . Например, хлорид натрия (NaCl) является растворённым веществом в растворе солёной воды. решение Однородная смесь , состоящая из нескольких веществ, обычно называется растворителем и растворёнными веществами . сольватированный электрон сольватация Любое стабилизирующее взаимодействие растворённого вещества с растворителем или аналогичное взаимодействие между растворителем и группами нерастворимого материала (например, ионными группами ионообменной смолы ). Такие взаимодействия обычно включают электростатические силы и силы Ван-дер-Ваальса , а также специфические для соединений эффекты, такие как водородные связи . [ 2 ] См. также растворение . сольватационная оболочка растворитель Часть раствора , в которой растворяется растворенное вещество . Например, вода (H 2 O) является растворителем в растворе солёной воды. обработка ультразвуком Процесс облучения вещества звуковой энергией, обычно на ультразвуковых (более 20 кГц ) частотах, для перемешивания частиц в образце с различными целями, такими как увеличение скорости химической реакции или получение пузырьков в смесях поверхностно-активных веществ и воды. [ 2 ] пространственный изомер См. стереоизомер . удельная теплоемкость ( c p ) Теплоёмкость образца вещества, делённая на массу образца. Грубо говоря, это количество тепла , которое необходимо добавить к одной единице массы вещества, чтобы повысить температуру на одну единицу. Единицей измерения удельной теплоёмкости в СИ является джоуль на кельвин на килограмм (Дж/К/кг). Удельная теплоёмкость часто зависит от температуры и от состояния вещества . спектрохимия спектрометрия Смотрите Масс-спектрометрию . спектроскопия Изучение излучения и вещества , например, рентгеновская спектроскопия поглощения и излучения. стандартное решение стандартные условия температуры и давления (STP) Стандартизация температуры окружающей среды и давления , используемая для того, чтобы легко сравнивать результаты экспериментов. Стандартная температура составляет 25 градусов Цельсия (° C), а стандартное давление - 100 000 килопаскалей (кПа). Стандартные условия часто обозначаются аббревиатурой STP или SATP . состояние материи Состояние вещества , существующее в определённой, однородной, макроскопической форме. Твёрдое , жидкое , газообразное и плазменное состояния являются четырьмя традиционными и наиболее известными состояниями вещества. См. также фаза . ступенчатая реакция стереохимия стереогенный центр стереоизомер Изомер , обладающий идентичным химическим составом , но отличающийся пространственным расположением атомов. стехиометрия Расчёт количества реагентов и продуктов в химических реакциях . Стехиометрия основана на законе сохранения массы и наблюдении, что количества реагентов и продуктов обычно находятся в соотношении, равном положительному целому числу. Это означает, что если известны количества отдельных реагентов, то можно рассчитать количества продуктов, и наоборот. сильная кислота Кислота , которая полностью диссоциирует в растворе в соответствии с реакцией или в такой степени, что концентрация недиссоциированных частиц слишком мала для измерения. Любая кислота с pK a , равным примерно -2, обычно считается сильной кислотой; примером является соляная кислота (HCl). Сравните с слабой кислотой . прочная основа структурная формула Графическое представление молекулярной структуры и геометрии конкретного химического соединения , показывающее, как атомы расположены в реальном трёхмерном пространстве. Химические связи внутри молекулы также показаны, явно или неявно. . Структурные формулы очень полезны, поскольку они позволяют химикам визуализировать молекулы и структурные изменения, которые происходят в них во время химических реакций . структурный изомер субатомная частица Любая частица, которая меньше атома . Примеры: протоны , нейтроны и электроны . сублимация Фазовый переход вещества из твёрдого состояния в газообразное топливо или газ без видимого промежуточного перехода в жидкое состояние. вещество См. химическое вещество . заместитель Атом или группа атомов, которые замещают или заменяют другой атом или группу атомов в более крупной молекуле в качестве продукта химической реакции , тем самым становясь частью вновь образованного соединения, как правило, без каких-либо значительных изменений в других частях той же молекулы. Например, гидроксильная группа может замещать любой из атомов водорода в бензоле с образованием фенола . См. также боковая цепь и функциональная группа . реакция замещения Тип химической реакции , при которой одна функциональная группа или заместитель в более крупном соединении замещает или подвергается замещению другой функциональной группой или заместителем. сверхтяжелые элементы См. трансактиниды . поверхностная наука поверхностное натяжение поверхностно - активное вещество Вещество, которое снижает поверхностное натяжение среды, в которой оно растворено , и/или межфазное натяжение с другими фазами и, соответственно, положительно адсорбируется на границе раздела жидкость — пар и/или других границах раздела. [ 2 ] приостановление действия Неоднородная смесь , содержащая твёрдые частицы, которые достаточно велики для осаждения , при котором такие частицы отделяются от жидкости и оседают в ней со временем, если их не перемешивать. В суспензии растворённое вещество не растворяется , а остаётся дисперсным или взвешенным в жидкости растворителе лишь временно и при механическом перемешивании. Сравните с коллоидами и растворами . потускнение Тонкий слой коррозии , образующийся на поверхности меди, латуни, алюминия, магния и других мягких металлов или сплавов в результате химической реакции их внешнего слоя с окружающим воздухом, часто, но не обязательно, с участием атмосферного кислорода. Оксидная плёнка обычно выглядит как тускло-серая, чёрная или иногда переливчатая плёнка или покрытие на металле. Это самоограничивающееся поверхностное явление, поскольку оксидированные верхние слои металла защищают нижележащие слои от реакции. температура Пропорциональная мера средней кинетической энергии хаотичных движений составляющих систему микроскопических частиц. Единицей измерения СИ температуры является кельвин . тройное соединение Химическое соединение , содержащее три разных элемента . [ 3 ] терпен Класс встречающихся в природе ненасыщенных углеводородов с углеродным скелетом, состоящим из одного или нескольких звеньев изопрена ( C 5 H 8 ). Т ерпены часто подразделяют на подклассы в зависимости от общего количества атомов углерода, которые они содержат, например, C 5 -гемитерпены, C 10 монотерпены , C 20 дитерпены и т. д. теоретический выход Смотрите на доходность . теплопроводность Свойство материала, позволяющее ему проводить тепловую энергию или тепло (величина, часто обозначаемая ). термохимия Изучение поглощения или выделения тепла во время химической реакции . термодинамическая стабильность Состояние системы, находящейся в наименьшем энергетическом состоянии по сравнению с окружающей средой (равновесие). термодинамика Изучение влияния изменения температуры, объёма или давления (или работы, тепла и энергии) в макроскопическом масштабе. термометр Прибор, используемый для измерения температуры . тиол 1. Любое из сероорганических соединений , состоящих из атома серы, присоединённого к атому водорода, и любого другого органического заместителя , с общей формулой R–SH. Тиолы — это сернистые аналоги спиртов . Также производные тиолов и меркаптаны . 2. Сама функциональная группа –SH. Также сульфгидрильная , сульфанильная и меркапто . титрование Лабораторный метод количественного химического анализа, который используется для определения концентрации идентифицированного анализируемого вещества . Процедура включает в себя приготовление определённого реагента в виде стандартного раствора известной концентрации и объёма (называемого титрантом или титровальным раствором ) и его реакцию с раствором анализируемого вещества (называемым титрантом ) для определения концентрации последнего. торр Единица измерения давления , эквивалентная 133,322 Па или 1,3158 × 10 −3 атм . микроэлемент Элемент в образце, средняя концентрация которого составляет менее 100 частей на миллион атомов или менее 100 микрограммов на грамм. [ 4 ] трансактиниды В периодической таблице набор химических элементов с атомным номером больше 103, то есть более тяжёлых, чем актиниды . Трансактиниды являются подмножеством трансурановых элементов . переходный металл Элемент , атомы которого в природе встречаются с неполностью заполненными «d»-подоболочками. Эти элементы сгруппированы в так называемые элементы d-блока в периодической таблице . трансурановые элементы Набор химических элементов с атомным номером , превышающим 92, то есть расположенных после урана в периодической таблице . Ни один из трансурановых элементов не является стабильным в естественных условиях. тройная связь Связь , которая включает ковалентное взаимодействие трёх пар электронов (например, двухатомная молекула азота N 2 состоит из двух атомов азота, связанных тройной связью). тройная точка Место, где температура и давление трёх фаз одинаковы. Вода имеет особую фазовую диаграмму. - Эффект Тиндаля
Эффект рассеяния света коллоидными или взвешенными частицами. - Номер ООН
Четырехзначный код, используемый для обозначения опасных и легковоспламеняющихся веществ. неопределенность Представление о том, что любое измерение, предполагающее оценку какого-либо количества, не может быть воспроизведено в точности. принцип неопределенности Знание местоположения частицы делает импульс неопределённым, а знание импульса частицы делает неопределённым её местоположение. элементарная ячейка Наименьшая повторяющаяся единица кристаллической решетки . единичный коэффициент Операторы, используемые при преобразовании между единицами измерения. неспаренный электрон вакуумная колба Сосуд для хранения, состоящий из двух колб или других ёмкостей, помещённых одна в другую и соединённых горлышками, с пространством между ними, из которого частично откачан воздух, что создаёт почти вакуум и значительно снижает передачу тепла между содержимым сосуда и окружающей средой. Вакуумные колбы могут значительно увеличить время, в течение которого их содержимое остаётся теплее или холоднее окружающей среды. валентный электрон Любые внешние электроны атома, которые находятся на электронных оболочках . теория валентных связей Теория, объясняющая химическую связь внутри молекул путём рассмотрения валентности , то есть количества химических связей, образуемых атомом. валентность Объединяющая способность элемента. van der Waals force Одна из сил (притяжения / отталкивания) между молекулами. фактор ван -т - Хоффа Отношение молей частиц в растворе к молям растворённого вещества . пар Когда вещество находится ниже критической температуры в газообразной фазе. давление пара Давление , оказываемое паром , находящимся в термодинамическом равновесии со своими конденсированными фазами ( твёрдой или жидкой ) при заданной температуре в замкнутой системе . Обычно его описывают как тенденцию частиц самопроизвольно переходить из жидкого или твёрдого состояния в газообразное и используют для определения скорости испарения жидкости. испарение Фазовый переход вещества из жидкого состояния в газообразное . точка испарения Смотрите температуру кипения . вязкость Мера сопротивления жидкости течению. волатильность Свойство материала, определяющее, насколько легко вещество испаряется . При заданной температуре и давлении вещество с высокой летучестью с большей вероятностью будет находиться в газообразном состоянии, а вещество с низкой летучестью с большей вероятностью будет находиться в жидком или твёрдом состоянии; соответственно, менее летучие вещества с большей вероятностью будут конденсироваться из газообразного состояния, чем более летучие. вольт (В) Производная единица измерения электрического потенциала , разности электрических потенциалов и электродвижущей силы , определяемая как один джоуль работы на кулон . вольтметр Прибор, измеряющий электрический потенциал элемента . объем Объём — это количество трёхмерного пространства , заключённого в замкнутую поверхность, или пространство, которое занимает или содержит вещество (твёрдое, жидкое, газообразное или плазменное) или форма. Единицей измерения объёма в СИ является кубический метр (м 3 ). объемный анализ Смотрите титрование . объемная колба часовое стекло Круглое вогнутое стекло, обычно используемое в химических лабораториях в качестве рабочей поверхности для различных целей, таких как выпаривание жидкостей, удерживание твёрдых веществ во время взвешивания, нагревание небольших количеств вещества или в качестве крышки для мензурки . вода Полярное неорганическое соединение с химической формулой H 2 O, представляющее собой бесцветную, не имеющую запаха и вкуса жидкость при стандартных температуре и давлении , хотя в природе она также встречается в виде твёрдого вещества и газа на поверхности Земли. Это самое распространённое вещество на Земле и, следовательно, неотъемлемый компонент практически всех химических и биологических систем. Воду часто называют «универсальным растворителем » из-за присущей ей способности растворять многие вещества. кристаллизационная вода Молекулы воды , присутствующие внутри кристаллов . При кристаллизации из воды или водных растворов многие соединения включают воду в промежутки между своими кристаллическими структурами; молекулы воды обычно присутствуют в стехиометрическом соотношении и могут в разной степени взаимодействовать с атомами кристалла. волновая функция Математическая функция, описывающая положение электрона в трёхмерном пространстве. слабая кислота Кислота , которая лишь частично диссоциирует при растворении в растворителе , потому что, согласно реакции , равновесие достигается, когда концентрация недиссоциированных частиц всё ещё значительна; примером является уксусная кислота (CH 3 COOH). В отличие от сильной кислоты . слабая база влажная химия Форма аналитической химии , которая использует классические лабораторные методы, такие как простое наблюдение и элементарные химические тесты, для изучения химических веществ и химических реакций, то есть без использования сложных приборов или автоматизированного или компьютеризированного анализа. Она часто используется в школах для обучения студентов основам химии. смачивающий агент работа подготовка к работе Ряд манипуляций, необходимых для выделения и очистки желаемого продукта или продуктов химической реакции . - Рентгеновский снимок
Форма ионизирующего электромагнитного излучения между гамма- и ультрафиолетовыми лучами в электромагнитном спектре . Дифракция рентгеновских лучей Лабораторный метод определения структуры кристаллического твёрдого тела путём направления на него рентгеновских лучей с одной длиной волны и анализа полученной дифракционной картины. - Рентгеновская фотоэлектронная спектроскопия
Спектроскопический метод, используемый для измерения химического состава материала. уступать Поддающееся количественной оценке количество продукта , образующегося в ходе химической реакции . энергия нулевой точки (ZPE) зона плавления Любой из нескольких методов очистки кристаллических твёрдых веществ, при которых к небольшому участку более крупного твёрдого вещества (в частности, металлического слитка ) прикладывается тепло до тех пор, пока не произойдёт локальное плавление и не образуется расплавленная зона, которую затем медленно перемещают по поверхности к другим участкам твёрдого вещества, перемещая нагревательный элемент. По мере продвижения передний край зоны расплава непрерывно плавит новые участки нечистого твёрдого вещества, оставляя за собой более чистый твёрдый материал по мере того, как ранее расплавленные участки охлаждаются и затвердевают. Поскольку расплавленная жидкая фаза может содержать более высокую концентрацию примесей, чем твёрдая фаза, примеси из расплавленных участков, как правило, концентрируются в зоне расплава и перемещаются вместе с ней, оставляя за собой участки с меньшим количеством примесей. Этот процесс обычно используется для очистки металлоидов высокой степени чистоты для применения в полупроводниках . цинк Металлический химический элемент с атомным номером 30 и символом Zn. цвиттерион Любая молекула, которая обладает внутренней полярностью благодаря наличию равного количества положительно и отрицательно заряженных функциональных групп .























![{\textstyle K_{{\ce {s}}}=[{\ce {A+}}]^{x}[{\ce {B-}}]^{y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/846796149c475d808bcf953cb72edfe83e6a6c62)
![{\textstyle [{\ce {A+}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1295d5e193de0a7dd071d683d08a0f3e2d60824e)
![{\textstyle [{\ce {B-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/449418fe3fa94f81a0a2156133bf8bda4b121720)



